Suppurative otitis media is a critical disease causing perforation of the tympanic membrane associated with changes of the mucoperiosteum of the middle ear cleft.
ObjectiveTo isolate causative bacteria from chronic suppurative ear discharges and to ascertain their antibiotic profiles, of patients attending outpatients department in 3 years.
MethodsFor isolation of bacteria, samples of ear discharges were grown in suitable media and bacteria were subjected to antibiotic profiling by the Kirby–Bauer's method with presently used antibiotics.
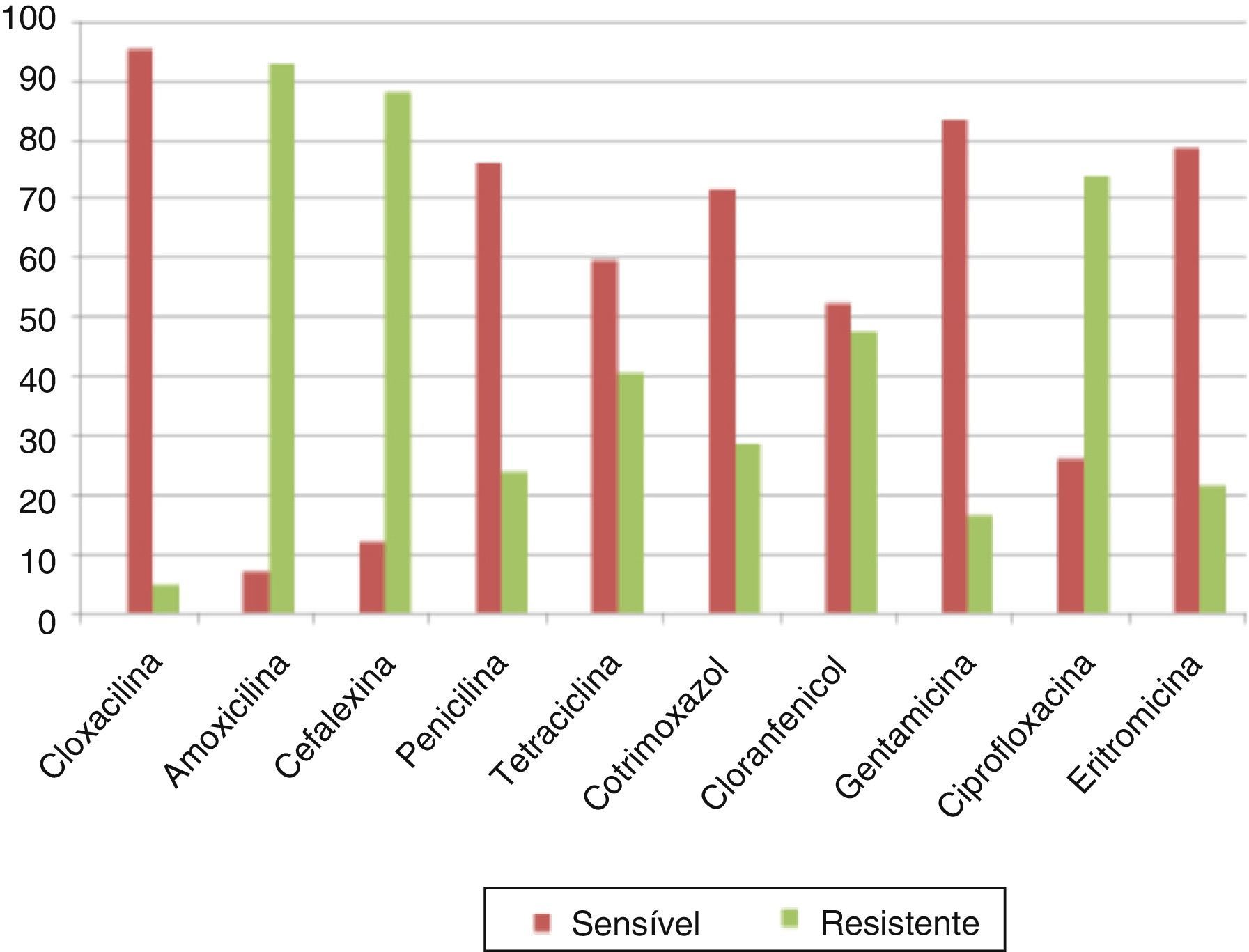
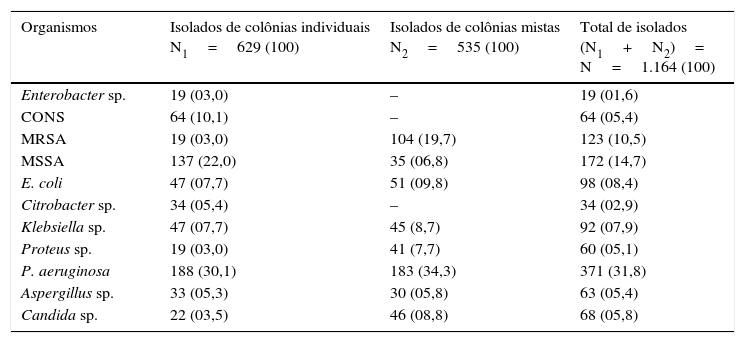
ResultsA total of 1043 bacteria were isolated, including Pseudomonas aeruginosa and methicillin resistant Staphylococcus aureus, along with 121 fungal isolates. Among 371 P. aeruginosa isolates, tobramycin 30 had the highest susceptibility rate 93.2%, followed by ceftazidime 30, 91.5% and amikacin 10μg/disk 64.4%. Of 359 S. aureus isolates, there were 236 coagulase negative S. aureus+methicillin sensitive S. aureus isolates, while 123 isolates were methicillin resistant Staphylococcus aureus with 95.2% isolates susceptible to cloxacillin 15, 83.3% isolates to erythromycin 15 and 78.5% isolates to gentamicin 30μg/disk. Of 1164, 49 patients presented post aural abscess, 12 patients had intracranial complications, 9 patients had facial palsy and 3 patients had labyrinthitis. More than 90% P. aeruginosa and 90% S. aureus isolates were sensitive to tobramycin 30 and cloxacillin 30μg/disk, respectively.
ConclusionMultidrug resistant strains of P. aeruginosa were more prevalent than those of S. aureus in ear discharges. Tobramycin and cloxacillin may be included in the formulatory antibiotic regimen to overcome bacterial infections in chronic suppurative otitis media.
Otite média supurativa é uma doença importante que causa perfuração da membrana timpânica, além de alterações do mucoperiósteo da orelha média.
ObjetivoIsolar as bactérias causadoras a partir da secreção auricular crônica e verificar seus perfis de sensibilidade aos antibióticos em pacientes ambulatoriais durante três anos.
MétodoPara o isolamento das bactérias, as amostras de secreções auriculares foram cultivadas em meios adequados e as bactérias foram submetidas à detecção de perfis de sensibilidade aos antibióticos com o método de Kirby‐Bauer para antibióticos usados na atualidade.
ResultadosNo total, 1.043 bactérias, incluindo Pseudomonas aeruginosa resistente à meticilina e Staphylococcus aureus, e 121 fungos isolados foram identificados. Entre 371 isolados de P. aeruginosa, tobramicina 30μg/disco apresentou a maior taxa de suscetibilidade (93,2%), seguida por ceftazidima 30μg/disco (91,5%) e amicacina 10μg/disco (64,4%). De 359 isolados de S. aureus, 236 eram S. aureus coagulase‐negativos+S. aureus sensíveis à meticilina (MSSA), enquanto 123 eram MRSA com 95,2% de suscetibilidade à cloxacilina 15μg/disco, 83,3% sensíveis à eritromicina 15μg/disco e 78,5% à gentamicina 30μg/disco. Entre 1.164 pacientes, 49 apresentaram abscesso aural, 12 complicações intracranianas, nove paralisia facial e três labirintite. Mais de 90% das P. aeruginosa isoladas e de 90% de S. aureus eram sensíveis à tobramicina 30μg/disco e cloxacilina 30μg/disco, respectivamente.
ConclusãoCepas multirresistentes de P. aeruginosa foram mais prevalentes do que as de S. aureus nas secreções auriculares. Tobramicina e cloxacilina podem ser consideradas na formulação de regime de antibióticos para tratar as infecções bacterianas na OMCS.
Genericamente, as “otites médias” incluem otites médias agudas (OMA) e otites médias com efusão (OME); mas essas não são cronicamente supurativas. A otite média crônica (OMC), por outro lado, pode ser acompanhada de secreção purulenta (OMCS) quando na presença de infecção e inflamação crônicas.1 A OMCS pode também permanecer inativa, com potencial de se ativar ocasionalmente, associada a uma perfuração da membrana timpânica e a alterações do mucoperiósteo da orelha média com ou sem otorreia mucoide ou mucopurulenta.1–3 Normalmente, leva cerca de duas a três ou mais semanas para a doença ser reconhecida como ativa. Uma OMC curada pode deixar anormalidades permanentes na pars tensa; mas, com uma pars tensa intacta, a ocorrência de OMC é mais rara.3 A OMCS pode levar a perda de audição e otalgia intermitente e as bactérias mais frequentemente encontradas em culturas incluem Klebsiella sp., Proteus sp., P. aeruginosa e S. aureus.4 Por outro lado, as bactérias mais comumente isoladas em pacientes com OMA são Haemophilus influenzae, Moraxella catarrhalis e Streptococcus pneumonia.5 A P. aeruginosa já foi relatada como um patógeno notório em hospitais.6 Pode ser encontrada em lesões cutâneas e no trato urinário, apresentar potencial de disseminação através da corrente sanguínea (ICS) e causar importantes comorbidades.7 Além disso, esses organismos têm capacidade de formar biofilmes que podem contribuir para a sua prevalência na OMCS.8 Sabe‐se bem que a dificuldade de erradicação de uma bactéria patogênica pode estar relacionada ao seu nível de resistência ao medicamento e também às condições imunes dos pacientes.9
Em particular, diversas variantes clonais de S. aureus inicialmente se mostraram resistentes ao grupo das penicilinas, motivo pelo qual foram introduzidas meticilina/oxacilina para o seu controle. Posteriormente, surgiram os S. Aureus (MRSA) resistentes à meticilina, que causam infecções de sítios cirúrgicos e de ferimentos abertos.10 Um fato alarmante foi que as cepas de MRSA emergiram com resistência concomitante/subsequente a outros grupos de antibióticos comumente usados, inclusive os aminoglicosídeos, macrolídeos, fluoroquinolonas, cloranfenicol, tetraciclina e outros, como as cefalosporinas e outros beta‐lactâmicos, tais como ampicilina‐sulbactam, e amoxicilina‐clavulanato, ticarcilina‐ácido clavulânico, piperacilina‐tazobactam, carbapenem e imipenem, de forma a tornarem‐se multirresistentes.11 Além disso, juntamente com MRSA, as espécies de fungos mais prevalentes eram Candida e Aspergillus; em um estudo de vigilância, 50% dos pacientes foram diagnosticados com candidíase.10Candida albicans era originalmente considerada um fungo inofensivo em pessoas saudáveis, mas, devido ao surgimento de resistência aos antifúngicos, atualmente pode se capaz de provocar desde infecções leves superficiais até infecções sistêmicas incontroláveis, muito graves.12
Este estudo identificou a flora bacteriana presente em otorreia purulenta crônica de pacientes portadores de OMCS atendidos no ambulatório do departamento de otorrinolaringologia de um hospital terciário, nos últimos três anos. Os dois fungos citados acima também foram isolados. O antibiograma das bactérias isoladas foi determinado para avaliar o espectro infeccioso das OMCS, com o intuito de reestruturar o programa de controle de infecção hospitalar do hospital e da zona central de Odisha.
MétodoForam colhidas amostras de secreção purulenta de 1.230 pacientes portadores de OMCS diagnosticados clinicamente, de janeiro de 2012 a janeiro de 2015. O material foi colhido com swabs de algodão estéreis; o material foi cultivado em placas de ágar‐sangue MacConkey e incubadas a 37°C durante a noite. As bactérias e os fungos foram identificados de acordo com métodos padronizados, concomitantemente para bactérias e fungos.6,13,14 Os testes de sensibilidade aos antibióticos das bactérias isoladas foram feitos a partir das recomendações do Clinical Laboratory Standard Institute, conforme descrito.15,16 Os discos de antimicrobianos padrão (HiMedia, Mumbai) usados para S. aureus foram oxacilina, cotrimoxazol, penicilina, cloxacilina, gentamicina, cloranfenicol, ciprofloxacina e vancomicina; discos semelhantes foram usados para P. Aeruginosa; com gentamicina, cloranfenicol, ciprofloxacina, ceftazidima, piperacilina, carbenicilina e tobramicina.
Detecção de MRSA e perfil de sensibilidade a antibióticosA cepa padrão MTCC‐7443 e todas as cepas isoladas de S. aureus foram submetidas a testes de sensibilidade a antibióticos com o método de Kirby‐Bauer (difusão em disco), detalhado anteriormente.11 Para a detecção de MRSA, foi usado teste em ágar cromogênico; isolados puros de S. aureus foram semeados em meios de MRSA‐ágar, como já descrito.11 Placas de ágar Muller‐Hinton foram incubadas a 37°C por 18h e os diâmetros da zona de inibição foram medidos. Um valor do diâmetro da zona de inibição inferior a 22mm foi considerado como resistente à oxacilina e acima de 21mm como sensível à oxacilina.11
Identificação de fungosO exame microscópico direto dos swabs foi feito mediante montagem de lotes de amostras tratadas com 1 a 2 gotas de KOH a 10 a 20%, entre 15 a 30min. Cada lote de amostras foi inoculado em dois conjuntos de meio de ágar Sabouraud dextrose, um conjunto com cloranfenicol e o outro com ciclo‐heximida (0,05mg/mL de cloranfenicol, 0,5mg/mL de cicloheximida). As culturas foram incubadas em temperatura ambiente entre 4 a 6 semanas e observadas regularmente para possível crescimento. Os isolados fúngicos foram identificados com base na duração do crescimento e na morfologia da superfície das colônias, bem como na produção de pigmentação reversa e no exame microscópico de hifas na preparação com lactofenol azul de algodão.6,16
ResultadosA partir de 1.230 amostras coletadas, houve crescimento de 1.164 colônias bacterianas e fúngicas: 629 como uma única colônia e 535 como colônias mistas em placas de ágar e em 66 amostras não houve crescimento microbiano. Foram identificados 1.043 isolados bacterianos e 121 isolados fúngicos. As bactérias patogênicas mais comumente isoladas foram S. aureus (220) e P. aeruginosa (188); e 19 isolados de S. aureus eram MRSA e 64 eram coagulase‐negativos (CONS). P. aeruginosa foi isolada em 183 amostras (do total de 1.164) e deram origem a colônias mistas de S. aureus, Klebsiella sp. e Proteus sp., seguidos de E. coli (tabela 1). Entre os fungos, 63 eram isolados de Aspergillus sp. e 68 de Candida sp., com colônias tanto individuais quanto mistas (tabela 1).
Crescimento de bactérias e fungos em culturas de amostras de descargas auriculares de pacientes ambulatoriais com OMCS, como colônias individuais e mistas
| Organismos | Isolados de colônias individuais N1=629 (100) | Isolados de colônias mistas N2=535 (100) | Total de isolados (N1+N2)= N=1.164 (100) |
|---|---|---|---|
| Enterobacter sp. | 19 (03,0) | – | 19 (01,6) |
| CONS | 64 (10,1) | – | 64 (05,4) |
| MRSA | 19 (03,0) | 104 (19,7) | 123 (10,5) |
| MSSA | 137 (22,0) | 35 (06,8) | 172 (14,7) |
| E. coli | 47 (07,7) | 51 (09,8) | 98 (08,4) |
| Citrobacter sp. | 34 (05,4) | – | 34 (02,9) |
| Klebsiella sp. | 47 (07,7) | 45 (8,7) | 92 (07,9) |
| Proteus sp. | 19 (03,0) | 41 (7,7) | 60 (05,1) |
| P. aeruginosa | 188 (30,1) | 183 (34,3) | 371 (31,8) |
| Aspergillus sp. | 33 (05,3) | 30 (05,8) | 63 (05,4) |
| Candida sp. | 22 (03,5) | 46 (08,8) | 68 (05,8) |
CONS, Staphylococcus coagulase‐negativa; MRSA, S. aureus resistente à meticilina; MSSA, S. aureus sensível à meticilina; valores percentuais estão entre parênteses; N ou total de colônias=1.164, de 1.230 amostras; as 66 amostras restantes não apresentaram crescimento; 121 (63+68) isolados fúngicos foram identificados.
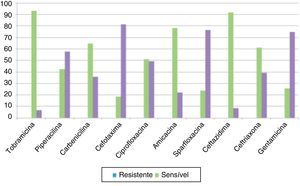
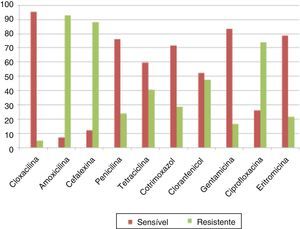
Os antibiogramas das bactérias mais comuns, P. aeruginosa e S. aureus (diferente de MRSA), são apresentados na figura 1. Entre as cepas de P. aeruginosa, tobramicina (30μg/disco) apresentou a taxa mais elevada de suscetibilidade (93,2%), seguida de 91,5% para ceftazidima (30μg/disc) e 64,4% para amicacina (10μg/disco) (fig. 2). Para S. aureus, 95,2% eram sensíveis à cloxacilina (15μg/disco), 83,3% à eritromicina (15μg/disco) e 78,5% à gentamicina (30μg/disco) (fig. 3). Todos os isolados de MRSA eram multirresistentes; porém, nenhum era resistente à vancomicina (30μg/disco).
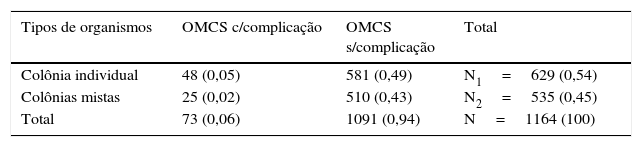
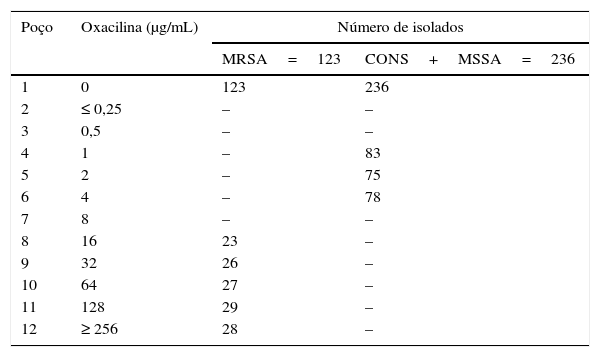
Das amostras dos 1.164 pacientes, 73 apresentavam OMCS com complicação e 1.091 apresentavam OMCS sem complicação, conforme detalhado: 48 casos com isolados bacterianos como única colônia, enquanto os 198 restantes com dois ou mais isolados bacterianos como colônias mistas (tabela 2). Dos 1.230 pacientes, 49 apresentavam abscesso retroauricular, 12 apresentavam complicações intracranianas, nove apresentavam paralisia facial e três apresentavam labirintite (tabela 3). Além disso, verificamos que a tendência de complicações intracranianas diminuiu gradualmente, enquanto as complicações extracranianas apresentaram uma tendência crescente, embora não tenha havido alteração significativa na incidência global de OMCS. Das 359 amostras de S. aureus, 123 cepas de MRSA e 236 de ‘CONS+(MSSA)’ (meticilina sensível a S. aureus) apresentaram colônias tanto individuais quanto mistas. As concentrações inibitórias mínimas (CIM) foram de 16‐512μg/mL para oxacilina e de 1‐4μg/mL para MRSA e ‘CONS+MSSA’. Esses valores de CIM confirmaram a presença de cepas de MRSA, pois o ponto de corte para a resistência à oxacilina era ≥ 4μg/mL (tabela 4).
Números de organismos que crescem em culturas de amostras de descargas auriculares de pacientes com OMCS com e sem complicação
| Tipos de organismos | OMCS c/complicação | OMCS s/complicação | Total |
|---|---|---|---|
| Colônia individual | 48 (0,05) | 581 (0,49) | N1=629 (0,54) |
| Colônias mistas | 25 (0,02) | 510 (0,43) | N2=535 (0,45) |
| Total | 73 (0,06) | 1091 (0,94) | N=1164 (100) |
Ver nota da tabela 1.
Número de pacientes com complicações como comorbidades causadoras de OMCS em três anos
| Ano | Paralisia facial | Complicação intracraniana | Abscesso pós‐aural | Labirintite | Total |
|---|---|---|---|---|---|
| 2012 | 3 | 3 | 16 | 2 | 24 |
| 2013 | 2 | 4 | 18 | 0 | 24 |
| 2014 | 4 | 5 | 15 | 1 | 25 |
| Total | 9 (12,9) | 12 (16,6) | 49 (67,1) | 3 (3,3) | 73 (100) |
Os valores percentuais estão entre parênteses.
Detecção de isolados de MRSA e ‘CONS+MSSA’ com base nos valores da CIM devido à oxacilina em uma placa de microtitulação de 12×8
| Poço | Oxacilina (μg/mL) | Número de isolados | |
|---|---|---|---|
| MRSA=123 | CONS+MSSA=236 | ||
| 1 | 0 | 123 | 236 |
| 2 | ≤ 0,25 | – | – |
| 3 | 0,5 | – | – |
| 4 | 1 | – | 83 |
| 5 | 2 | – | 75 |
| 6 | 4 | – | 78 |
| 7 | 8 | – | – |
| 8 | 16 | 23 | – |
| 9 | 32 | 26 | – |
| 10 | 64 | 27 | – |
| 11 | 128 | 29 | – |
| 12 | ≥ 256 | 28 | – |
A solução estoque de oxacilina de 512μg/mL foi diluída em série em cada poço sucessivo, a partir do poço 12, para a concentração final de 0,25μg/mL de oxacilina no segundo poço; –, sem crescimento; total de Staphylococcus sp.=MRSA com 123+(CONS+MSSA) com 236=359 colônias. Os resultados do segundo experimento repetido são apresentados.
A OMCS é uma doença associada à alteração estrutural da orelha média e anomalia permanente da pars tensa ou pars flácida, que ocorrem principalmente como sequelas de efusão da orelha média de longa data, OMA inadequadamente tratada, disfunção da trompa de Eustáquio ou até de uma pressão negativa na orelha média. Nos países em desenvolvimento, pobreza, ignorância, escassez de especialistas e acesso limitado ao atendimento médico, entre outros, conspiram para agravar a ocorrência e as complicações da OMCS.17 Má condição de vida, falta de acesso a cuidados médicos, tratamento médico inadequado, infecções recorrentes do trato respiratório superior e doenças nasais foram reconhecidos como fatores de risco para OMCS.18 A doença ático‐antral acomete mais comumente a pars flácida e o quadrante posterior‐superior da pars tensa. Caracteriza‐se pela formação de uma bolsa de retração, na qual queratina e detritos epiteliais descamados se acumulam e dão origem a um colesteatoma; que em última análise foi considerada uma forma perigosa da doença, devido ao potencial de desenvolvimento de várias complicações intracranianas e extracranianas.11
Embora os estafilococos façam parte da flora normal, pela sua característica invasiva, podem causar uma variedade de infecções. Além disso o S. aureus é o patógeno nosocomial e comunitário mais notório. Embora a relevância clínica do CONS permaneça controversa, os pacientes em risco de infecções incluem recém‐nascidos, pacientes com cateteres e indivíduos imunocomprometidos com dispositivos protéticos e feridas cirúrgicas. A capacidade notável que o S. aureus e CONS apresentam de adquirir resistência aos antibióticos limita as opções terapêuticas, aumenta as taxas de morbidade e mortalidade e os custos de hospitalização.19 Particularmente, diversas variantes clonais de S. aureus e MRSA foram relatadas como resistentes ao grupo das penicilinas, meticilina/oxacilina. Além disso, em um estudo alemão, relatou‐se que a maior parte das cepas de MRSA era proveniente de feridas infeccionadas (56,9%), seguidos de casos de pneumonia (21,0%) e de ICS (15,1%).11
ConclusãoAs cepas multirresistentes de P. aeruginosa e MRSA foram as mais prevalentes nas secreções auriculares de pacientes com OMCS. Dos 1.164 pacientes, 49 apresentavam abscesso pós‐aural, 12 complicações intracranianas, nove paralisia facial e três labirintite. Este estudo concluiu que ciprofloxacina é menos eficaz no tratamento de OMCS ativa e que tobramicina e cloxacilina podem ser usadas no seu tratamento.
FinanciamentoEste estudo foi subsidiado pelo grande projeto de pesquisa n° BT/PR8214/PBD/17/863/2013 sobre infecções bacterianas do Departamento de Biotecnologia (DBT), Governo da Índia, Nova Delhi, atribuído a RN Padhy. Este trabalho é parte da tese de doutorado de SN Rath, um JRF no projeto DBT, em Biotecnologia da Universidade S‘O’A, Bhubaneswar. Agradecemos ao Prof. Rankanidhi Samal pela apreciação crítica e ao Prof. DK Roy, diretor‐médico do IMS e Sum Hospital, Bhubaneswar, pelas instalações.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.
Como citar este artigo: Rath S, Das SR, Padhy RN. Surveillance of bacteria Pseudomonas aeruginosa and MRSA associated with chronic suppurative otitis media. Braz J Otorhinolaryngol. 2017;83:201–6.