Introdução: Acredita-se que o fator de crescimento vascular endotelial (FCEV) seja um importante fator angiogênico envolvido no crescimento, na progressão e na metástase tumoral.
Objetivo: O presente estudo avalia a relação entre a expressão tecidual e os níveis séricos e salivares do FCEV em carcinomas de células escamosas da cabeça e pescoço (CCECPs) e sua correlação com aspectos clinicopatológicos.
Método: Foram coletadas amostras de 30 pacientes com CCECP e de 24 voluntários saudáveis. Utilizamos análise imuno-histoquímica para a expressão tecidual e ELISA para determinação dos níveis séricos e salivares.
Resultados: Não foi observada coloração para FCEV nos tecidos normais, enquanto que foi observada expressão de FCEV em seis pacientes (20%). O nível sérico médio de FCEV foi 83,7 ± 104,47 em pacientes e 50,04 ± 32,94 em controles. O nível salivar médio de FCEV foi de 174,41 ± 115,07 em pacientes e 149,58 ± 101,88 em controles. Não foi observada diferença significativa pelo teste de Mann-Whitney entre controles e pacientes (respectivamente, p = 0,411, p = 0,944). Não foi observada relação entre a expressão tecidual de FCEV e seus níveis séricos e salivares.
Conclusão: A expressão elevada de FCEV foi observada em pacientes com CCECP, e isso sugere seu papel na patogênese de CCECP, mas não foi observada relação entre a expressão tecidual e os níveis séricos e salivares desse marcador.
Introduction: Vascular endothelial growth factor is thought to be an important angiogenic fator involved in tumor growth, progression, and metastasis.
Objective: The present study evaluated the relation between tissue expression, serum and salivary levels of vascular endothelial growth factor in head and neck squamous cell carcinomas, and their correlation with clinicopathologic features.
Methods: Samples were collected from 30 patients with head and neck squamous cell carcinomas and 24 healthy volunteers. Immunohistochemical analysis was used for tissue expression andenzyme-linked immunosorbent assay was employed to measure serum and salivary levels.
Results: No vascular endothelial growth factor staining was observed in normal tissues, whereas vascular endothelial growth factor expression was seen in 6 patients (20%). Mean serum level of VEGF was 83.7 ± 104.47 in patients and 50.04 ± 32.94 in controls. Mean salivary level of vascular endothelial growth factor was 174.41 ± 115.07 in patients and 149.58 ± 101.88 in controls. No significant difference was found by Mann-Whitney test between controls and patients (p = 0.411, p = 0.944, respectively). No correlation was found between vascular endothelial growth fator tissue expression and its serum and salivary level.
Conclusion: Overexpression of vascular endothelial growth factor was found in head and neck squamous cell carcinoma patients, suggesting its role in the pathogenesis of head and neck squamous cell carcinoma, but no relation was found between tissue expression, serum levels,and salivary levels of this marker.
Pagina nueva Introdução
A angiogênese é um fenômeno importante no desenvolvimento dos tumores e das metástases, sendo decorrente da secreção de diversos fatores de crescimento por células tumorais e pelo ambiente circunjacente ao tumor. Embora o desenvolvimento de um tumor seja um processo multifásico, a angiogênese se faz necessária tanto para o seu crescimento como para o desenvolvimento de metástases.1,2
Sabe-se que o fator de crescimento endotelial vascular (FCEV) é um regulador fundamental da angiogênese, acelerando a proliferação celular, a permeabilidade vascular e a migração de células endoteliais e é um inibidor da apoptose.3 FCEV é uma glicoproteína ligante da heparina, e seu gene está localizado no cromossomo 6.1 Esta proteína é a mais importante na família dos FCEVs, tendo um papel na permeabilidade vascular.4 A inibição da atividade do FCEV leva à diminuição do crescimento e à redução na progressão tumoral, sugerindo que essa proteína desempenha papel importante na iniciação da angiogênese tumoral.5 Além disso, ficou determinado que a condição de hipóxia pode aumentar a expressão do FCEV, e a expressão elevada de FCEV leva à angiogênese na área hipóxica dos tumores.6
A expressão de FCEV ocorre em vários tumores malignos, o que sugere um importante papel no processo da angiogênese. A expressão elevada de FCEV foi observada em tumores sólidos, como os do cólon, rim, mama, cérebro, pâncreas, bexiga, ovário, estômago, pulmão e boca.7
Com relação ao papel do FCEV no processo angiogênico, o objetivo desse estudo foi investigar a expressão e os níveis séricos e salivares desse marcador em pacientes com carcinoma de células escamosas de cabeça e pescoço (CCECP).
Método
Neste estudo transversal foram examinados 30 pacientes com CCECP (21 homens e nove mulheres) que tinham sido encaminhados para os hospitais Khalili e Chamran da Universidade Shiraz de Ciências Médicas. O grupo controle consistiu de 24 indivíduos saudáveis (16 homens e oito mulheres), pareados com o grupo de pacientes em idade e gênero.
Indivíduos portadores de qualquer doença sistêmica, infecção ativa, doença autoimune, doença inflamatória e problemas periodontais foram excluídos do estudo. Com relação ao grupo de pacientes, aqueles que apresentavam histórico de radioterapia ou quimioterapia, ou com outros cânceres, foram excluídos do estudo.
Foram examinadas lâminas coradas por H&E dos pacientes com CCE, e as lâminas com tecido suficiente foram selecionadas para estudos imuno-histoquímicos (IHC). As seguintes informações foram coletadas dos prontuários clínicos dos pacientes: idade, gênero, localização do tumor, tamanho, metástase e estadiamento, além de hábito do consumo de tabaco. O Comitê de Ética da Universidade Shiraz de Ciências Médicas aprovou o estudo, e todos os pacientes assinaram um formulário de consentimento informado para sua participação.
A preparação do soro sanguíneo foi realizada na manhã anterior à cirurgia, com a coleta de 5 cc de sangue venoso com o paciente em NPO durante 12 horas. As amostras de sangue foram imediatamente centrifugadas a 3000 rpm ´ 10 min. Em seguida, o soro foi separado e armazenado a –80ºC até a análise.8
Quanto à saliva, na manhã anterior à cirurgia foram coletadas amostras não estimuladas de saliva integral, com o paciente em NPO durante 12 horas.
Os pacientes foram solicitados a evitar, por 30 minutos, a ingestão de alimentos e bebidas, devendo ainda se abstrair de fumar durante esse período. Em seguida, os lábios dos pacientes foram higienizados e cada paciente lavou sua boca com água. Aproximadamente 5-10 mL de saliva foram coletados de cada paciente. Depois da centrifugação das amostras (g ´ 2600, 15 min, 40ºC), estas foram armazenadas a -80ºC até seu uso.9
Análise do soro sanguíneo e da saliva
A concentração de FCEV (Bender Med Systems GmbH, Alemanha) foi medida com o uso de um imunoensaio enzimático de fase sólida (ELISA), conforme instruções do fabricante.
Coloração imuno-histoquímica
A coloração IHC foi realizada com o uso do EnvsionLabled Peroxidase System (DAKO, Carpentaria, CA, Estados Unidos). Todas as amostras foram fixadas em formalina tamponada a 10% e, em seguida, incluídas em parafina. Foram preparadas secções com 4 µm de espessura, diafanizadas em xilenol, reidratadas em uma bateria gradativa de álcool e, em seguida, lavadas com água destilada. A recuperação do antígeno foi efetuada com o uso de solução de recuperação (DAKO cytomation target retrieval solution) com pH = 9 durante 20 minutos. A atividade de peroxidase interna foi inibida por H2O2 a 3%. Em seguida, as secções teciduais foram incubadas durante 30 minutos com o anticorpo anti-FCEV (anticorpo murino anti-humano, Dako Corporation, Dinamarca) em uma diluição de 1/25. As amostras normais foram coradas com a mesma quantidade de anticorpo utilizada na coloração das células tumorais. A omissão do anticorpo primário foi utilizada como controle negativo, enquanto que granuloma piogênico foi utilizado como controle positivo. A ocorrência de uma coloração castanha do citoplasma para FCEV foi considerada como positiva.
Inicialmente, as lâminas coradas foram examinadas com pequena magnificação. Para aquelas lâminas exibindo coloração heterogênea, foram estudadas as regiões com coloração mais intensa. Foram escolhidos cinco campos aleatoriamente, tendo sido contadas 500 células; a seguir, foi calculado o percentual de coloração. A extensão da coloração foi classificada como: 0 se 0-10% das células tumorais estivessem coradas; 1 se 11-25% estivessem coradas; 2 se 26-50% estivessem coradas; e 3 se mais de 50% estivessem coradas.1
Análise estatística
Em seguida, foi feita a inserção dos dados no programa estatístico SPSS (Statistical Package for Social Science), versão 18.0. Inicialmente, a normalidade dos dados foi examinada com a aplicação do teste de Kolmogorov-Smirnov. Tendo em vista que as variáveis em estudos não exibiam distribuição normal, foram utilizados os testes de Mann-Whitney, Kruskal-Wallis e do Qui-quadrado para comparação dos dois grupos. As diferenças foram consideradas significantes quando p < 0,05.
Resultados
Descrição das variáveis
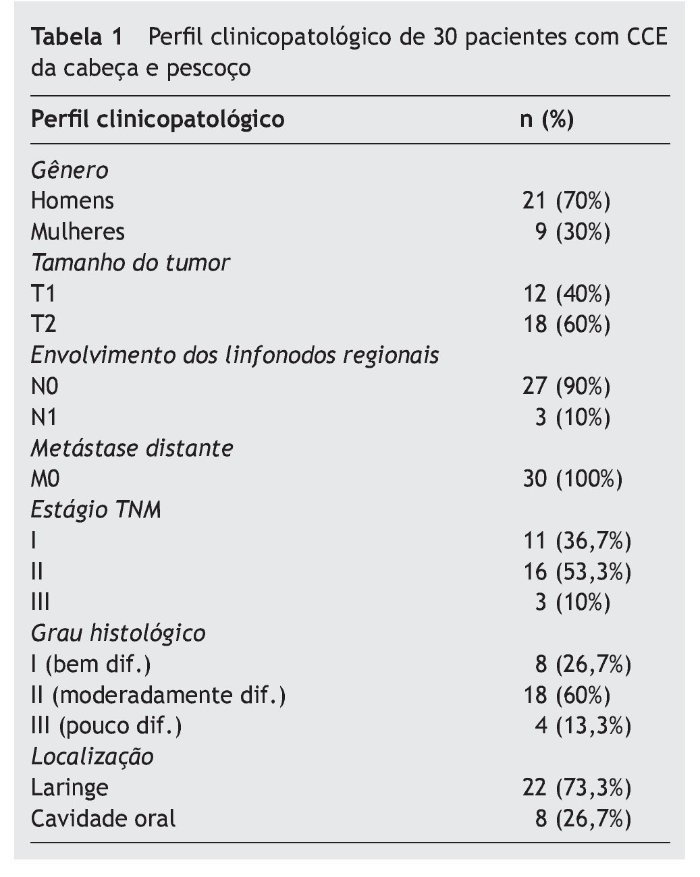
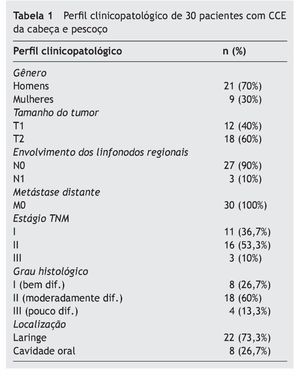
O presente estudo foi realizado em 30 pacientes com CCE da cabeça e pescoço (21 homens e nove mulheres) com média de idade de 56,76 ± 12,46 anos. A tabela 1 lista os aspectos clinicopatológicos dos pacientes.
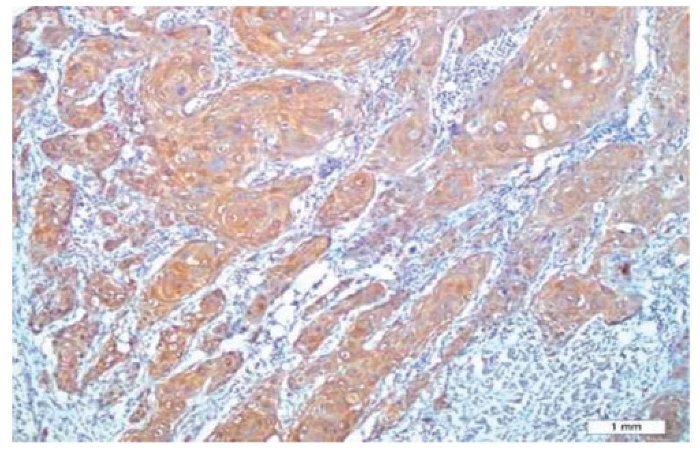
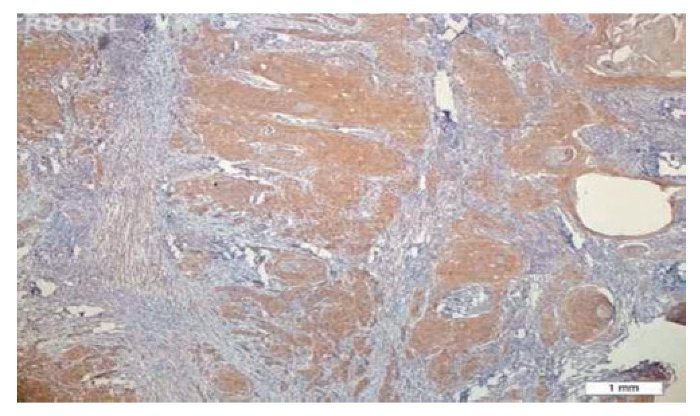
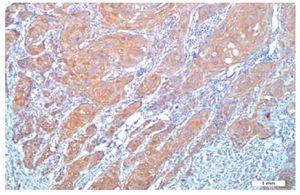
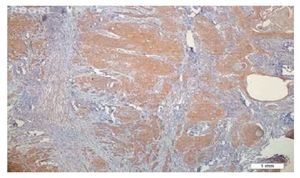
Não foi observada coloração de FCEV nos tecidos normais, enquanto que foi notada a expressão desse marcador em seis pacientes (20%); quatro deles tiveram escore 1, e dois escore 2. Não foi observada expressão de FCEV ao redor das pérolas de queratina (figs. 1 e 2).
Figura 1 Coloração citoplasmática de FCEV em carcinoma de células escamosas (´ 200).
Figura 2 A expressão de FCEV foi negativa em torno das pérolas de queratina (´ 100).
Os resultados indicaram que a comparação da expressão tecidual de FCEV entre casos e controles demonstrou diferença significante (p = 0 / 023), sendo mais elevada no grupo de pacientes com CCE vs. controles. Não foi observada correlação na expressão de FCEV com os seguintes aspectos clinicopatológicos: estágio, tamanho do tumor, situação nos linfonodos e grau histológico.
O nível sérico médio de FCEV foi de 83,7 ± 104,47 pg/mL nos pacientes e de 50,04 ± 32,94 pg/mL nos controles. O nível salivar médio de FCEV foi de 174,41 ± 115,07 pg/mL nos pacientes e de 149,58 ± 101,88 pg/mL nos controles. Não foi observada diferença significativa no teste de Mann-Whitney entre controles e pacientes (respectivamente, p = 0,411, p = 0,944).
Também não foi observada correlação significante pelo teste de Mann-Whitney entre a expressão tecidual de FCEV e seus níveis séricos e salivares (respectivamente, p = 0,517, p = 0,716). As relações entre os níveis séricos e salivares de FCEV e outras variáveis, como, por exemplo, idade, gênero, graus de M, N, T e estadiamento tumoral, foram examinadas separadamente, não tendo sido observada qualquer relação significativa entre os níveis séricos ou salivares e as variáveis mencionadas.
Discussão
FCEV foi identificado como um fator efetivo para indução da angiogênese, sendo um mitógeno potente para as células endoteliais.10 No presente estudo, foi observada expressão de FCEV em 20% das amostras tumorais, enquanto que nenhuma das amostras teciduais do grupo de controle demonstrou positividade; além disso, foi observada uma diferença significante entre os controles e os tumores, no que se refere à expressão de FCEV. Neste estudo, o aumento da expressão de FCEV está em acordo com os achados em outros estudos realizados em pacientes com CCEs da cavidade oral e da cabeça e pescoço.10-12 Mas, em nosso estudo, o percentual de expressão de FCEV foi baixo, em comparação com outros estudos; isso pode ter sido resultado do nosso pequeno número de pacientes, em comparação às demais investigações. A relação entre a expressão de FCEV e determinados parâmetros, como diferenciação tumoral, metástase para linfonodos e profundidade da invasão, foi investigada em vários estudos.13 Os resultados concernentes à investigação da relação entre a expressão de FCEV e os fatores acima mencionados em pacientes com CCE da cabeça e pescoço foram diferentes. Tse et al. (2007) constataram a inexistência de relação entre expressão de FCEV e grau histopatológico e localização do tumor, mas o aumento na expressão de FCEV resultou em diminuição da taxa de sobrevida.14 Kyzas et al. (2005) não constataram relação entre expressão de FCEV e grau e estágio do carcinoma de cabeça e pescoço. Esses autores declararam que a expressão de FCEV em lesões benignas foi superior à de carcinomas e displasias, e também constataram que a expressão de FCEV tem papel fundamental no ajustamento da condição fisiológica normal da mucosa.15 Nesse estudo não foi observada relação entre a expressão de FCEV e fatores clinicopatológicos. As controvérsias e os diferentes achados podem ser decorrentes do pequeno tamanho da amostra, do método distinto utilizado na classificação da expressão de FCEV, da variedade dos tumores com relação à sua localização primária e dos diferentes estágios dos pacientes, entre o presente estudo e as demais investigações. No presente estudo, a maioria dos pacientes foi classificada nos estágios I e II. No estudo, o nível sérico de FCEV no grupo de pacientes foi ligeiramente superior ao nível sérico desse marcador no grupo de controle, mas essa diferença não foi significante (p > 0,05). Em contraste com outros estudos, observamos aumento no nível sérico de FCEV no grupo de pacientes.7,16
Foi observada uma forte correlação entre o nível sérico de FCEV e CCE da cabeça e pescoço nos pacientes em estágios elevados.17 Com efeito, nos demais estudos a maioria dos pacientes tinha sido classificada como tendo a doença em estágio elevado, mas a maioria dos nossos pacientes se situava nos estágios I e II, sem ocorrência de metástases distantes. Assim, é mais adequado comparar este estudo com aqueles semelhantes, como o de Wu e Meyer.18,19 Consonante com o nosso estudo, na investigação de Wu e Meyer a maioria dos pacientes foi classificada nos estágios I e II, e quase todas as lesões se localizavam na laringe. Esses autores não observaram elevação significante no nível de FCEV. No presente estudo, não foi observada relação significante entre o nível sérico de FCEV e fatores clinicopatológicos, enquanto que Shang et al. (2007) chegaram a um nível elevado de FCEV em pacientes com metástases em linfonodos.8
Meyer et al. (2010), em um estudo bastante parecido com o nosso no que diz respeito à seleção das amostras, estágio e localização (esses autores investigaram amostras da laringe), não notaram relação entre o nível circulatório de FCEV e fatores clinicopatológicos.18 A saliva é um dos fluidos corporais de mais fácil acesso, e sua preparação independe de método invasivo. A saliva é conhecida como o “espelho do corpo”, e sua aplicação foi investigada no diagnóstico de doenças sistêmicas e marcadores tumorais.20 A saliva é identificada como fonte de FCEV. Foi demonstrado que a angiogênese fisiológica e patológica na mucosa oral e nos tecidos salivares é regulada pelo FCEV salivar.21 A presença de FCEV na saliva de pacientes normais sugere um papel importante para FCEV na manutenção da homeostase da membrana mucosa.22 No presente estudo, o nível salivar de FCEV em pacientes com CCE foi mais elevado do que o nível no grupo controle, mas não foi notada uma diferença estatisticamente significante. Upile et al. (2009) examinaram o nível salivar de FCEV-165, e os resultados demonstraram que os níveis séricos e salivares desse marcador nos pacientes foram significantemente mais elevados do que os níveis observados no grupo de controle.23 Esses autores investigaram a quantidade de FCEV-165 por imunoensaio, enquanto que, no nosso estudo, o nível salivar de diversas isoformas de FCEV foi investigado por ELISA. Assim, essa diferença pode ter sido resultado dos diferentes métodos de determinação das isoformas. Em nosso estudo não foi observada relação entre o nível salivar de FCEV e fatores clinicopatológicos. No estudo de Upile et al. (2009) não foi investigada a relação entre o nível salivar de FCEV e fatores clinicopatológicos.23 Por ocasião da revisão do artigo, não encontramos um estudo que investigasse a relação entre o nível salivar de FCEV e fatores clinicopatológicos.
Conclusão
No presente estudo, foi observada uma elevada expressão de FCEV em pacientes com CCECP, o que sugere um papel desse marcador na patogênese do CCECP, mas não foi observada qualquer relação entre a expressão tecidual e os níveis séricos e salivares de FCEV.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Os autores gostariam de agradecer à Vice-Reitoria de Pesquisa da Universidade Shiraz de Ciências Médicas por seu apoio financeiro para esse estudo (Subvenção # 90-5551). Esse manuscrito é relevante para a tese de pós-graduação do Dr. Marzieh Hamzavi.
Recebido em 21 de julho de 2013;
aceito em 9 de março de 2014
☆Como citar este artigo: Andisheh-Tadbir A, Hamzavi M, Rezvani G, Ashraf MJ, Fattahi MJ, Khademi B, et al. Tissue expression, serum and salivary levels of vascular endothelial growth factor in patients with HNSCC. Braz J Otorhinolaryngol. 2014;80:503-7.
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2014.03.001
* Autor para correspondência.
E-mail:feresh_876@yahoo.com (F. Kamali).