Eosinophilic and noneosinophilic Nasal polyps (NPs) are different subtypes of NPs and require different treatment methods.
ObjectiveTo compare the histologic characteristics, mRNA and protein expression between Nasal Polyps with and without eosinophilia.
MethodsNPs tissues were obtained from eighty‐six NPs patients during surgery. Eosinophilic and noneosinophilic NPs were distinguished according to immunochemical results of the specimen. The histological, mRNA and protein expression features were compared between the two groups.
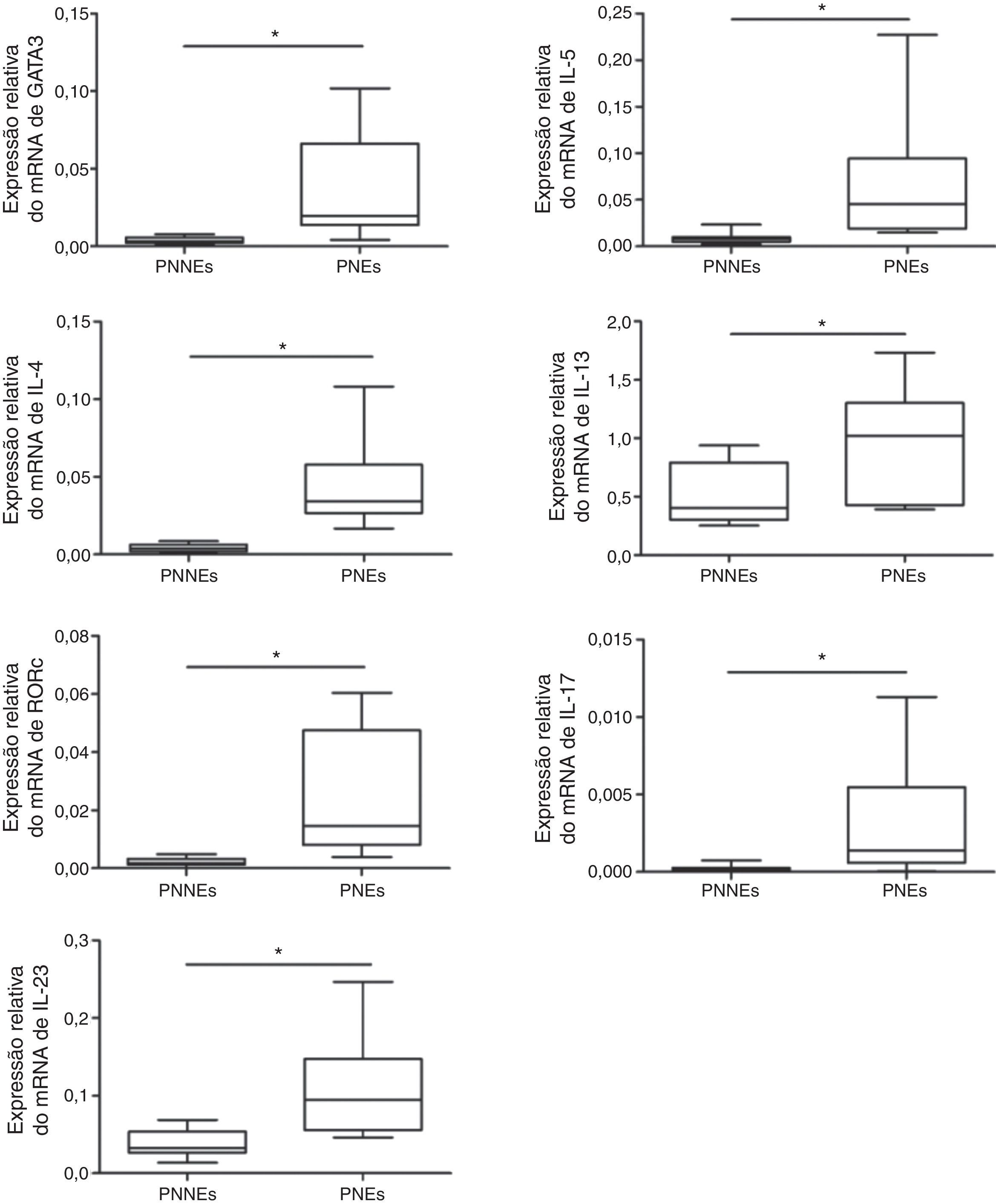
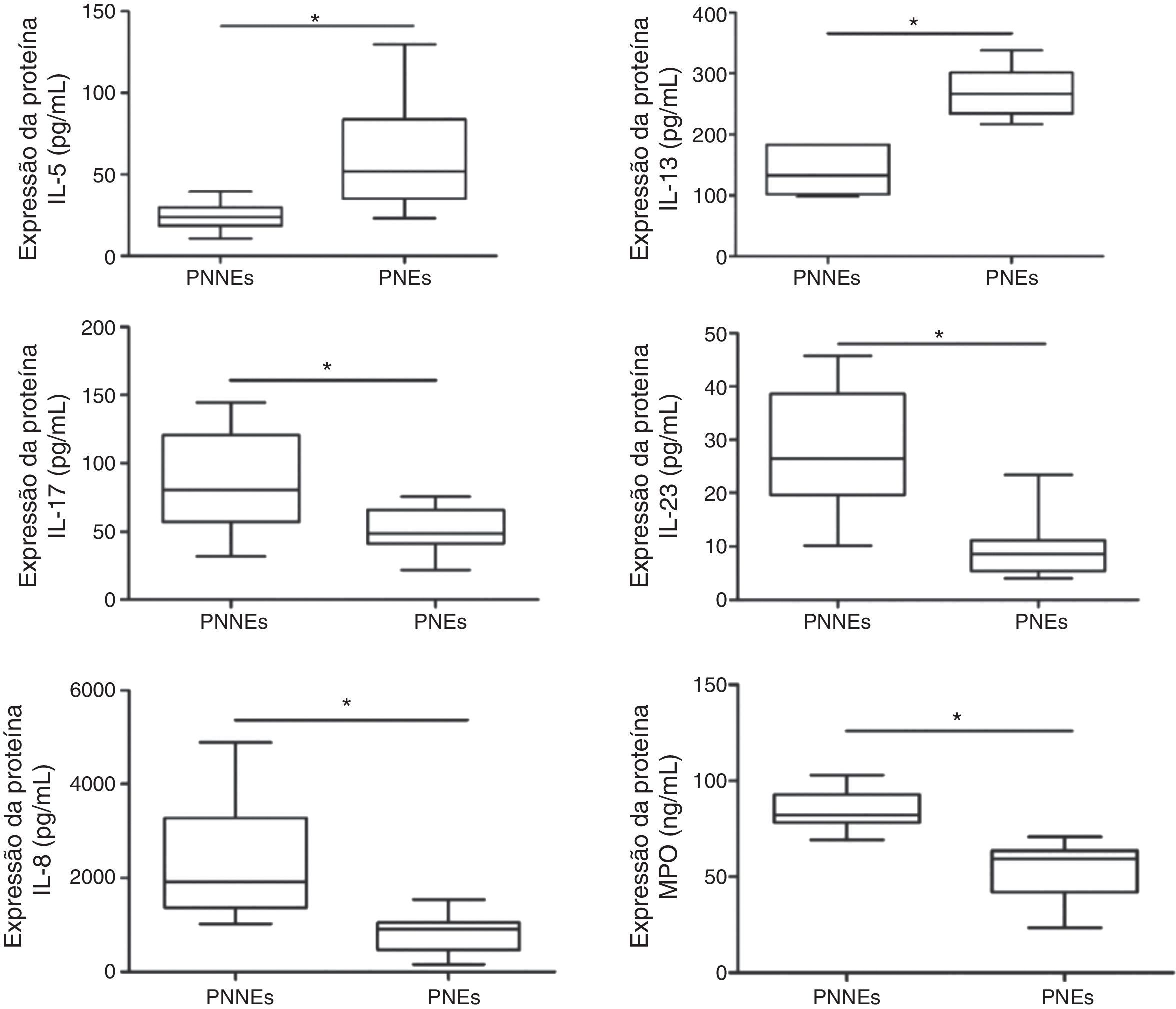
ResultsIn eosinophilic NPs, we observed a significantly higher GATA‐3, IL‐5, IL‐4, IL‐13 mRNA and protein expression. In noneosinophilic NPs, IL‐17, IL‐23 and RORc mRNA and protein expression were increased. Immunohistochemistry tests showed, more mast cells and less neutrophils in eosinophilic NPs compared with noneosinophilic NPs. Eosinophilic NPs patient presented more severe symptom scores when compared to noneosinophilic NPs.
ConclusionWe demonstrate for the first time that Th2 is the predominant reaction in eosinophilic NPs while Th17 is the predominant reaction in noneosinophilic NPs. Our study may provide new treatment strategy for NPs.
Pólipos nasais (PNs) eosinofílicos e não eosinofílicos são diferentes subtipos de PNs e requerem diferentes métodos de tratamento.
ObjetivoComparar as características histológicas e a expressão de mRNAs e proteínas entre PNs com e sem eosinofilia.
MétodoAmostras de PNs foram obtidos de 86 pacientes durante a cirurgia. PNs eosinofílicos e não eosinofílicos foram diferenciados segundo os resultados imunoistoquímicos de cada amostra. As características histológicas e de expressão de mRNAs e de proteínas foram comparadas entre os dois grupos.
ResultadosEm PNs eosinofílicos, observamos uma expressão significativamente maior dos mRNAs e proteínas GATA‐3, IL‐5, IL‐4 e IL‐13. Nos PNs não eosinofílicos, aumentou a expressão dos mRNAs e das proteínas IL‐17, IL‐23 e RORc. Nos testes imunoistoquímicos, observamos maior número de mastócitos e menor número de neutrófilos nos PNs eosinofílicos, em comparação com PNs não eosinofílicos. Os pacientes com PNs eosinofílicos obtiveram escores de sintomas mais graves vs. PNs não eosinofílicos.
ConclusãoDemonstramos, pela primeira vez, uma reação Th2 predominante em PNs eosinofílicos e uma reação Th17 predominante em PNs não eosinofílicos. Nosso estudo pode proporcionar novas estratégias terapêuticas para a rinossinusite crônica.
A rinossinusite crônica (RSC) é caracterizada pela inflamação persistente da mucosa nasal e paranasal e dividida em dois tipos, de acordo com a ausência ou presença de pólipos nasais (PNs): RSC sem PNs e RSC com PNs (RSCcPN).1 As características histológicas dos PNs são: inflamação com células Th2 acompanhada por infiltração com eosinófilos, espessamento da membrana basal e hiperplasia do epitélio.2–5 Na população ocidental, pode‐se observar infiltração por eosinófilos na maioria dos PNs e esse achado é considerado um importante marcador patológico para PNs.6,7 No entanto, diversos estudos sobre PNs em pacientes chineses mostraram que muitos desses pacientes se apresentavam com inflamação não eosinofílica.8 Muitos deles demonstraram que um percentual considerável de PNs em pacientes chineses exibia predominância de neutrófilos, mas ainda não havia um detalhamento da diferença entre PNs eosinofílicos e não eosinofílicos.9
Estudos similares demonstraram que a asma eosinofílica responde ao tratamento farmacológico com glicocorticoides, mas a não eosinofílica pode apresentar tolerância a esses medicamentos.10,11 Em um estudo recentemente publicado por Wen, sobre a resposta de pacientes com PNs à terapia oral com corticosteroides, foi constatado que pacientes com PNs eosinofílicos se mostravam mais sensíveis aos corticosteroides vs. pacientes com PNs não eosinofílicos.12 Além disso, os PNs eosinofílicos exibem maior tendência para recidivas pós‐operatórias. Todos esses estudos demonstraram que os PNs eosinofílicos e não eosinofílicos podem, na verdade, ser subtipos distintos de PNs, necessitando de métodos terapêuticos diferentes.
Neste estudo, objetivamos investigar a expressão dos principais fatores de transcrição e de citocinas para células Th1/Th2/Th17 entre PNs eosinofílicos e não eosinofílicos e também fornecer novas informações sobre a RSCcPN.
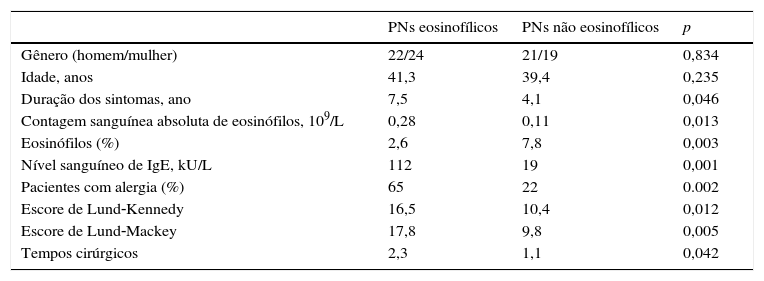
MétodoPacientesEm nosso estudo, recrutamos consecutivamente 86 pacientes. O diagnóstico se fundamentou principalmente no exame histopatológico. De acordo com métodos prévios,13 os PNs eosinofílicos e não eosinofílicos foram categorizados com base nos resultados imunoistoquímicos (IHQ), pela presença de < 5 ou ≥ 5 eosinófilos/campo de grande ampliação (cga), respectivamente. Os dados basais foram coletados e, em seguida, obtivemos os escores de Lund‐Kennedy e Lund‐Mackey, com o objetivo de avaliar a gravidade dos PNs. Nenhum dos participantes tinha usado corticosteroides orais ou nasais nas quatro semanas anteriores à cirurgia. Os detalhes de todos os participantes estão resumidos na tabela 1. O estudo foi aprovado pelo Comitê de Ética local (n° 20130106), e os participantes deram consentimento livre e informado.
Características demográficas e clínicas de pacientes com PNs eosinofílicos e não eosinofílicos
| PNs eosinofílicos | PNs não eosinofílicos | p | |
|---|---|---|---|
| Gênero (homem/mulher) | 22/24 | 21/19 | 0,834 |
| Idade, anos | 41,3 | 39,4 | 0,235 |
| Duração dos sintomas, ano | 7,5 | 4,1 | 0,046 |
| Contagem sanguínea absoluta de eosinófilos, 109/L | 0,28 | 0,11 | 0,013 |
| Eosinófilos (%) | 2,6 | 7,8 | 0,003 |
| Nível sanguíneo de IgE, kU/L | 112 | 19 | 0,001 |
| Pacientes com alergia (%) | 65 | 22 | 0.002 |
| Escore de Lund‐Kennedy | 16,5 | 10,4 | 0,012 |
| Escore de Lund‐Mackey | 17,8 | 9,8 | 0,005 |
| Tempos cirúrgicos | 2,3 | 1,1 | 0,042 |
PNs, pólipos nasais.
Cada amostra foi dividida em duas partes: uma foi armazenada a ‐80°C para a análise de mRNAs e proteínas; a outra parte foi empregada na coloração IHQ.
Escores para sintomasDurante a consulta clínica, os pacientes foram submetidos a uma avaliação geral dos sintomas da rinite. Os sintomas de obstrução e prurido nasal, espirros e rinorreia foram classificados em uma escala de 4 pontos, na qual 0=ausência de sintomas, 1=sintomatologia leve, 2=sintomatologia moderada e 3=sintomatologia grave. Os escores totais para os sintomas variaram de 0 a 12 e representaram o somatório dos escores para bloqueio nasal, prurido nasal, espirros e rinorreia.
Coloração imunoistoquímicaPara a imunoistoquímica, as secções foram submetidas a desparafinização e desidratação; em seguida, foram colocadas em H2O2 0,3% durante 20 minutos à temperatura laboratorial, para redução da coloração de fundo inespecífica. Em seguida à recuperação do antígeno em tampão citrato 10 mM durante 15 minutos, procedeu‐se incubação noturna com anticorpo monoclonal anti‐humano para MBP (eosinófilos, 1:100, Santa Cruz), anti‐HNE (neutrófilos, 1:200, Dako) e antitriptase (mastócitos, 1:100, Santa Cruz) a 4°C, respectivamente, para a coloração imunoistoquímica. No dia seguinte, as secções foram lavadas com PBS e incubadas com o anticorpo secundário (Gene Tech, Shanghai, China) à temperatura laboratorial, durante uma hora.
Depois da lavagem, e submetidos a coloração com DAB (Gene Tech, Shanghai, China) sob microscopia, as secções foram contracoradas com hematoxilina de Mayer (Dako) durante 40 segundos, desidratadas seriadamente em etanol, diafanizadas com xilenol (3 vezes) e montadas com bálsamo neutro (Dako). O controle para a coloração inespecífica foi feito rotineiramente com PBS, em lugar dos anticorpos primários; todos os espécimes se revelaram negativos.
As secções foram visualizadas com um microscópio Olympus CX40 (Olympus Europa GmbH, Alemanha) e o número de células positivas foi contado em campo de grande ampliação (×400). Dez campos foram examinados em cada amostra e, em seguida, calculamos a mediana para cada anticorpo.
Análise de PCR em tempo realA análise de PCR em tempo real foi feita conforme descrição prévia. O mRNA total foi extraído de SIP ou de tecidos da mucosa com o uso do reagente TRIzol (Life Technologies, Carlsbad, CA, EUA), de acordo com as instruções do fabricante. Precedeu‐se à transcrição reversa (TR) e o cDNA foi sintetizado a partir de 2 μg de RNA total com uso de um primer oligo (dT) 18 e por transcriptase reversa de M‐MLV (Takara, Syuzou, Shiga, Japão). A expressão do mRNA foi determinada com o uso do Sistema de Detecção ABI PRISM 7300 (Applied Biosystems, Foster City, CA, EUA) e de SYBR Premix Taq™ (Takara). As sequências dos primers estão listadas na tabela 2. As amostras PRISM continham 1×SYBR Green Master Mix, 1,5 μL de 5 μM primers, e 25 ng de cDNA sintetizado em um volume de 25 μL. As reações foram aquecidas a 95°C durante 10min, seguidas por 40 ciclos de desnaturação a 95°C durante 10 seg e com extensão de anelamento a 60°C durante 60 seg. Todas as reações de PCR foram feitas em duplicata. Foi usada a análise da curva de desnaturação para o controle da especificidade da ampliação. O valor médio para os replicados foi calculado para cada amostra e foi expresso como valor de limiar de ciclo (Ct). A expressão relativa de cada gene‐alvo foi determinada como a diferença (ΔCt) entre o valor de Ct do gene‐alvo e o valor de Ct da ß‐actina. As mudanças de enovelamento no mRNA do gene‐alvo foram determinadas como 2−ΔΔCt.
Primers usados para a análise PCR quantitativa da expressão gênica de fatores transcricionais e citocinas
| Primer | Sequência |
|---|---|
| T‐bet | (s) 59‐GTCAATTCCTTGGGGGAGAT‐39 |
| (a) 59‐TCATGCTGACTGCTCGAAAC‐39 | |
| GATA‐3 | (s) 59‐CTGGCCACAGTTGTTTCATG‐39 |
| (a) 59‐GCAACTGGTGAACGGTAACA‐39 | |
| RORC | (s) 59‐GCTGTGATCTTGCCCAGAACC‐39 |
| (a) 59‐CTGCCCATCATTGCTGTTAATCC‐39 | |
| IL‐4 | (s) 59‐CCACGGACACAAGTGCGATA‐39 |
| (a) 59‐CCCTGCAGAAGGTTTCCTTCT‐39 | |
| IL‐5 | (s) 59‐CCCACAAGTGCATTGGTGAA‐39 |
| (a) 59‐CCTCAGAGTCTCATTGGCTATCAG‐39 | |
| IL‐17 | (s) 59‐CAAGACTGAACACCGACTAAG‐39 |
| (a) 59‐TCTCCAAAGGAAGCCTGA‐39 | |
| IL‐13 | (s) 59‐TGAGGAGCTGGTCAACATCA‐39 |
| (a) 59‐CAGGTTGATGCTCCATACCAT‐39 | |
| IL‐23 | (s) 59‐GAGCAGCAACCCTGAGTCCCTA‐39 |
| (a) 59‐CAAATTTCCCTTCCCATCTAATAA‐39 | |
| GAPDH | (s) 59‐ACCCAGAAGACTGTGGATGG‐39 |
| (a) 59‐TTCTAGACGGCAGGTCAGGT‐39 |
A amostra de tecido recém‐obtida foi pesada, foi adicionado um cocktail de inibidores da protease (Keygentec, Nanjing, China) para cada 100mg de tecido. Em seguida, o tecido foi homogeneizado com o uso de um homogeneizador (Kinematica, Suíça) durante um min, em gelo. Depois da homogeneização, a suspensão foi centrifugada a 4000 rpm durante 20 min a 4°C e o sobrenadante foi armazenado a ‐80°C até o momento da análise.
Foram usados kits de ensaio imunoabsorvente ligado à enzima (Elisa) para a determinação dos níveis teciduais de IL‐5, IL‐4, IL‐13, IL‐17, IL‐23, IL‐8 e MPO (R&D Systems, Minneapolis, MN, USA), em conformidade com os protocolos do fabricante. Cada amostra foi testada em duplicata. Os limites de detecção dos testes foram: IL‐5, 3,9 pg/mL; IL‐4, 31,2 pg/mL; IL‐13, 62,5 pg/mL; IL‐17, 31,2 pg/mL; IL‐23, 39 pg/mL; MPO, 1,56 mg/mL; IL‐8, 3,9 pg/mL.
Análise estatísticaTodos os dados foram expressos como média±DP. A significância estatística entre os dois grupos foi determinada com a aplicação do teste U de Mann‐Whitney. Consideramos p<0,05 como representativo de diferença significante.
ResultadosPacientesCom base em nossos critérios histológicos, 46 pacientes com PNs (53,5%) foram classificados no subgrupo eosinofílico e 40 com PNs (46,5%) foram classificados no subgrupo não eosinofílico. As características demográficas e clínicas dos pacientes estão listadas na tabela 1. Em comparação com os pacientes com PNs não eosinofílicos, aqueles com PNs eosinofílicos apresentaram duração mais prolongada dos sintomas, contagem absoluta de eosinófilos mais alta, níveis sanguíneos de IgE mais altos, maior percentual de história de alergia, maior proporção de eosinófilos, escores de Lund‐Kennedy e Lund‐Mackey mais altos, maiores tempos cirúrgicos e escores mais altos para a sintomatologia. Em termos de idade e gênero, não houve diferença significante entre pacientes com PNs eosinofílicos e não eosinofílicos.
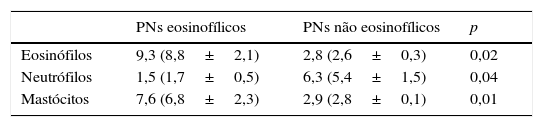
Comparação da histologia entre PNs eosinofílicos e não eosinofílicosConstatou‐se que o número de células inflamatórias totais em PNs eosinofílicos aumentou significantemente, em comparação com PNs não eosinofílicos (dados não apresentados). Com relação aos tipos celulares, os PNs eosinofílicos exibiam maior número de mastócitos, exceto para eosinófilos, enquanto os PNs não eosinofílicos apresentavam maior infiltração por neutrófilos (tabela 3). Nossos resultados também demonstraram que 85% dos PNs eosinofílicos tinham mais de seis mastócitos por cga, enquanto todos os PNs não eosinofílicos tinham menos de três mastócitos por cga. Por outro lado, os PNs não eosinofílicos exibiam grande infiltração por neutrófilos. No total, 90% dos PNs não eosinofílicos tinham mais de cinco mastócitos por cga, enquanto todos os PNs eosinofílicos tinham menos de dois neutrófilos por cga. Também analisamos a relação entre o número de eosinófilos e outras células e constatamos que o número de eosinófilos tinha correlação positiva com o número de mastócitos (r=0,68; p<0,001) e com o total de células inflamatórias (r=0,46; p<0,05); mas não observamos relação entre eosinófilos e neutrófilos.
Escore mediano e IC de 95% (média±EPM) das contagens celulares em pacientes com PNs eosinofílicos e não eosinofílicos (por campo de grande ampliação)
| PNs eosinofílicos | PNs não eosinofílicos | p | |
|---|---|---|---|
| Eosinófilos | 9,3 (8,8±2,1) | 2,8 (2,6±0,3) | 0,02 |
| Neutrófilos | 1,5 (1,7±0,5) | 6,3 (5,4±1,5) | 0,04 |
| Mastócitos | 7,6 (6,8±2,3) | 2,9 (2,8±0,1) | 0,01 |
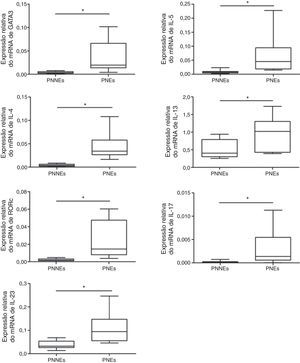
Nos PNs eosinofílicos, observamos expressão mais alta de fatores de transcrição e de citocinas de Th2 (GATA‐3, IL‐5, IL‐4, IL‐13), enquanto que nos PNs não eosinofílicos observamos expressão mais alta para os fatores de transcrição e citocinas de Th17 (RORc, IL‐17A, e IL‐23) (fig. 1). Para os fatores de transcrição e citocinas de Th1 (T‐bet e IFN‐γ), não observamos diferença entre os dois grupos (dados não apresentados).
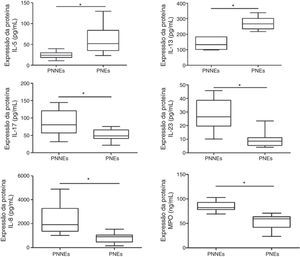
Comparação da expressão de proteínas entre PNs eosinofílicos e não eosinofílicosDe maneira similar ao que ocorreu com a expressão de mRNA, as citocinas de Th2 (IL‐5 e IL‐13) estavam significativamente mais altas nos PNs eosinofílicos e as citocinas de Th17 (IL‐17A e IL‐23) estavam significativamente mais altas nos PNs não eosinofílicos (fig. 2). Contudo, não foi possível detectar a expressão da proteína IL‐4 em ambos os grupos (dados não apresentados). Em relação à expressão das citocinas de Th1 (IL‐12 e IFN‐γ), não foram observadas diferenças entre os dois grupos (dados não apresentados). Além disso, a expressão de marcadores de neutrófilo (IL‐8, MPO) estava mais alta em PNs não eosinofílicos vs. eosinofílicos. Na análise da relação entre expressão das citocinas, observou‐se que IL‐17A apresentava correlação positiva tanto com a expressão de IL‐8 como de MPO (r=0,53, p<0,01; r=0,57, p<0,05).
DiscussãoNas populações caucasianas, PNs são considerados eventos orquestrados por células Th2 e a eosinofilia tecidual é uma característica muito importante.14–16 A infiltração e a ativação dos eosinófilos na mucosa nasal podem promover a secreção de proteínas granulares específicas, a síntese e a liberação de mediadores lipídicos, citocinas inflamatórias, quimiocinas e fatores do crescimento. Por meio desses mediadores químicos, os eosinófilos contribuem para o desenvolvimento dos PNs; mas diversos estudos demonstraram que menos de 50% dos pacientes com PNs na China ou em outros países asiáticos apresentavam inflamação eosinofílica.17,18 Tal achado significa que os PNs são heterogêneos e podem ser divididos, em termos gerais, em dois subtipos: PNs eosinofílicos e não eosinofílicos. Os PNs eosinofílicos podem ser adequadamente controlados pela terapia com corticosteroides, enquanto os não eosinofílicos respondem a uma combinação de cirurgia endoscópica e terapia com macrolídeos.19–21
Em nosso estudo, o grupo dos PNs eosinofílicos demonstrou maior prevalência de alergia e de níveis de IgE. Tendo em vista que a contagem de eosinófilos no sangue tem correlação significativa com infiltração dos pólipos nasais por essas células, ela poderia ser um bom marcador para inflamação eosinofílica em pacientes com PNs. Todos esses dados indicaram que a ocorrência de PNs eosinofílicos estava intimamente relacionada à alergia, embora o seu papel na patogênese das PNs ainda seja objeto de controvérsia. Alguns estudos questionaram o papel da alergia na patogênese dos PNs. Caplin et al. avaliaram 3.000 pacientes atópicos e observaram que apenas 0,5% desses pacientes também apresentava PNs. Outros artigos também não foram capazes de demonstrar uma incidência mais alta de atopia em pacientes com PNs, ou de um padrão de inflamação alérgica na patogênese dos PNs.22–24 Assim, nosso estudo sugere a necessidade de pesquisas com coortes maiores, para essa comprovação. Também constatamos que a infiltração por eosinófilos estava diretamente correlacionada com a gravidade da doença, pois tanto os escores totais como os escores para cada item estavam aumentados nos PNs eosinofílicos. Em conjunto, nossos resultados sugerem que os PNs eosinofílicos prenunciam uma longa duração da doença e um prognóstico pior.
Nos testes histológicos, constatamos a ocorrência de uma reação inflamatória mais grave nos PNs eosinofílicos, que se apresentou por maior infiltração de mastócitos e eosinófilos e por maior infiltração de neutrófilos nos PNs não eosinofílicos. O mastócito é a principal célula efetora das reações alérgicas mediadas por IgE, por liberar histamina e outros agentes químicos envolvidos na inflamação alérgica; a infiltração dessa célula nos PNs eosinofílicos sugere que uma resposta imune mediada por linfócitos T pode desempenhar papel importante nos PNs eosinofílicos. Em concordância com esses resultados, nossos dados demonstraram que o número de eosinófilos estava positivamente correlacionado com o número de mastócitos e de células inflamatórias totais. Com frequência, acredita‐se que a infiltração por neutrófilos esteja relacionada com infecção bacteriana, mas nossos resultados demonstraram que esse tipo de infiltração também estava envolvido na inflamação crônica. Nagakura sugeriu que a atividade quimiotáxica neutrofílica de alto peso molecular estava relacionada à hipersensibilidade nasal. Além disso, a elastase liberada pelos neutrófilos em seguida à degranulação pode desempenhar papel importante na lesão aos tecidos.25,26
Estudos já publicados confirmaram o papel da célula Th na patogênese da RSC; diante disso, comparamos a expressão de mRNAs e de proteínas entre os dois grupos. Nossos resultados revelaram reação Th2 predominante em PNs eosinofílicos e reação Th17 predominante em PNs não eosinofílicos, mas observamos a expressão de fatores de transcrição (T‐bet e IFN‐γ) e de citocinas entre os dois grupos. Há necessidade da presença de GATA‐3 para um compromisso orientado para as células Th2 e para o controle da expressão de IL‐5.27–30 A super‐regulação de GATA‐3 em PNs eosinofílicos se refletiu no subsequente aumento no mRNA e na proteína IL‐5. Como marcador para células Th17, analisamos o fator de transcrição RORc, foi constatada expressão significativamente maior em PNs não eosinofílicos.31,32 De forma semelhante, os níveis das citocinas de Th17 (IL‐17A e IL‐23) estavam significativamente mais elevados nos PNs não eosinofílicos. Em concordância com nossos resultados, estudos prévios demonstraram que o eixo IL‐17‐IL‐23 desempenha papéis importantes na patogênese dos PNs. Como esperado, os marcadores de neutrófilos (IL‐8, MPO) nos PNs não eosinofílicos estavam mais elevados vs. marcadores de PNs não eosinofílicos. Também verificamos que IL‐17A demonstrava uma correlação positiva com a expressão tanto de IL‐8 como de MPO. Isso sugere que IL‐17 pode estar relacionado à migração dos neutrófilos; assim, esse mecanismo merece uma exploração mais aprofundada.
ConclusãoEm resumo, nossos dados demonstraram pela primeira vez a reação Th2 predominante em PNs eosinofílicos e a reação Th17 predominante em PNs não eosinofílicos. Nosso estudo pode proporcionar uma nova estratégia terapêutica para os PNs.
Padrões éticosOs autores afirmam que os procedimentos contributivos para este estudo seguem os padrões éticos das orientações nacionais e institucionais relevantes sobre experimentação em seres humanos e também a Declaração de Helsinque de 1975, com revisão em 2008.
FinanciamentoFundação para Pesquisas Científicas Médicas da Província de Guangdong, China, A2013518.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sun C, Ouyang H, Luo R. Distinct characteristics of nasal polyps with and without eosinophilia. Braz J Otorhinolaryngol. 2017;83:66–72.
Ambos os autores contribuíram igualmente para o artigo.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.