Há um acúmulo de evidências sobre os inibidores de morte celular programada‐1 no carcinoma nasofaríngeo. Porém, os estudos clínicos anteriores foram quase todos feitos com amostras de tamanho pequeno.
ObjetivoResumir os estudos existentes para comparar de forma abrangente os inibidores de morte celular programada‐1 em carcinoma nasofaríngeo com ou sem quimioterapia.
MétodoA pesquisa foi feita em diferentes bases de dados em busca de publicações de texto completo que usaram um inibidor de morte celular programada‐1 com ou sem quimioterapia. Nenhuma heterogeneidade entre os estudos foi detectada e modelos de efeito fixo foram aplicados para sintetizar os dados.
ResultadosSete estudos foram incluídos. A duração média da sobrevida livre de progressão no tratamento com inibidores de morte celular programada‐1 foi de 4,66 meses. A taxa de sobrevida livre de progressão em seis meses foi de 50%; no entanto, a taxa de sobrevida livre de progressão em 12 meses caiu para 27%. Em comparação com a monoterapia com inibidor de morte celular programada‐1, a taxa de resposta objetiva (taxa de resposta combinada = 2,90, IC de 95%: 2,07–4,08). A taxa de resposta parcial foi maior em pacientes que receberam morte celular programada‐1 em combinação com quimioterapia (taxa de resposta combinada=3,09, IC 95%: 2,15‐4,46). Ao contrário, a taxa de progressão da doença foi menor no grupo com terapia combinada (taxa de resposta combinada=0,06, IC de 95%: 0,01–0,31). A condição de estabilidade da doença com ou sem quimioterapia foi comparável (taxa de resposta combinada=0,90, IC de 95%: 0,50–1,64). O uso isolado de morte celular programada‐1 ou combinado com quimioterapia não influenciou a ocorrência de eventos adversos totais (taxa de resposta combinada=0,99, IC de 95%: 0,93–1,05). No entanto, a terapia combinada pode aumentar o risco de eventos adversos graves, como anemia, trombocitopenia e neutropenia.
ConclusãoO presente estudo fez um resumo da eficácia e segurança dos inibidores de morte celular programada‐1 em carcinoma nasofaríngeo. A terapia combinada mostrou uma atividade antitumoral maior, excetuando‐se o risco maior de mielossupressão.
O carcinoma nasofaríngeo (CNF) tem características óbvias de distribuição geográfica, especialmente no leste e sudeste asiático,1 e a terapia com inibidor de ponto de controle imunológico (immune checkpoint inhibitor – ICI) foi um avanço no tratamento de doenças recorrentes ou metastáticas de CNF.2,3 O checkpoint imunológico é um tipo de molécula imunossupressora que desempenha um papel importante no desenvolvimento de tumor maligno.4–6 Os checkpoints imunológicos provaram ser alvos eficazes para suprimir células tumorais.7,8 A descoberta de checkpoints imunológicos, como a proteína‐4 associada a linfócitos T citotóxicos (cytotoxic T‐lymphocyte‐associated protein‐4 – CTLA‐4),9 o ligante‐1 de morte celular programada‐1 (programmed cell death‐1 ligand‐1 – PD‐L1)10,11 e o inibidor de morte celular programada‐1 (PD‐1),10,11 é de grande importância para o desenvolvimento de imunoterapia tumoral. Nos últimos anos, a imunoterapia representada pelos inibidores de ponto de controle imunológico PD‐1/PD‐L1 mudou a situação atual do tratamento antitumoral em CNF.2,12 Um estudo de dois braços que envolveu 67 pacientes com CNF recorrente e metastático classificou os grupos em inibidor anti‐PD1+quimioterapia e inibidor anti‐PD1 isolado e relatou que a adição de quimioterapia ao inibidor anti‐PD1 melhorou significativamente a SLP e a sobrevida global (SG) em seis meses dos pacientes com CNF.13 Um estudo de fase 1/2, aberto, não comparativo, que objetivou investigar a segurança e a atividade antitumoral do inibidor de PD‐1 (tislelizumabe) em tumor sólido mostrou que o evento adverso mais comum foi anemia e aumento da aspartato aminotransferase. Respostas antitumorais foram observadas no subgrupo de pacientes com CNF.14 A eficácia de nivolumabe, outro inibidor anti‐PD‐1, foi comprovada em pacientes com vários tipos de carcinoma espinocelular recorrente e metastático de tumor sólido.15 Sato et al.,16 relataram que os pacientes com CNF selecionados de múltiplas instituições apresentaram alta taxa de sobrevida em um ano (75,8%), indicaram que o nivolumabe é um medicamento sistêmico de segunda linha útil e relativamente seguro em pacientes com CNF. Outras evidências relativas ao nivolumabe vieram do estudo feito por Ma et al.17 Nesse estudo de fase I/II, os autores investigaram a segurança e a farmacocinética de nivolumabe em uma coorte chinesa de pacientes com CNF. Eventos adversos relacionados ao tratamento ocorreram em 76% dos pacientes com Grau 1–2. Esse estudo indicou que nivolumabe de 3mg/kg e em doses fixas de 240mg e 360mg foi bem tolerado em pacientes com CNF e a eficácia mostrou que o nivolumabe apresentou atividade antitumoral promissora em CNF avançado. Um estudo adicional sobre a atividade antitumoral de nivolumabe em pacientes com CNF mostrou que os pacientes com CNF múltiplo ou metastático pré‐tratado em tratamento com nivolumabe até a progressão da doença obtiveram uma TRO global de 20,5%. Além disso, esse estudo mostrou por análise descritiva que a proporção dos pacientes que responderam foi maior entre aqueles com tumores PD‐L1 positivos que entre aqueles com tumores PD‐L1 negativos, sugeriu que nivolumabe tem atividade antitumoral promissora em CNF e hipotetizou a expressão de PD‐L1 em tecido local como um preditivo de resposta ao tratamento com nivolumabe.18 Fang et al.19 fizeram um estudo de fase‐1 de dois braços, com pacientes com CNF, confirmaram histologica ou citologicamente, receberam monoterapia com camrelizumabe ou terapia combinada (camrelizumabe+quimioterapia). O camrelizumabe como um dos inibidores anti‐PD‐1 foi considerado uma opção de tratamento potencial e bem tolerada para pacientes com CNF recorrente ou metastático. Além disso, a toxicidade da combinação de camrelizumab mais gencitabina e cisplatina foi controlável e a atividade antitumoral da terapia combinada foi promissora. O perfil de segurança e a atividade antitumoral de pembrolizumab (Keytruda), um anticorpo monoclonal humanizado anti‐PD1, foram verificados em pacientes com tumores sólidos avançados positivos para PD‐L1. Além disso, a coorte com CNF nesse estudo incluiu doença irressecável ou metastática e pembrolizumabe demostrou atividade antitumoral e um perfil de segurança gerenciável em vinte e sete pacientes com CNF que receberam monoterapia.20
Como mostrado nos estudos clínicos mencionados acima, as evidências do tratamento com anti‐PD‐1 em CNF tem se acumulado. Contudo, os estudos clínicos anteriores continham amostras de tamanho pequeno. Além disso, resultados contraditórios foram obtidos. Nosso estudo teve como objetivo fazer um resumo dos estudos existentes para, de modo geral, interpretar a condição de sobrevida dos pacientes com CNF. Além disso, este estudo foi desenhado para comparar de forma abrangente a eficácia e a segurança dos inibidores de PD‐1 como terapia combinada em CNF com ou sem quimioterapia.
MétodoEstratégia de buscaConduzimos esta metanálise das literaturas atuais de acordo com as diretrizes dos principais itens para relatar revisões sistemáticas e metanálises (preferred reporting items for systematic reviews and meta‐analyses – PRISMA). Uma pesquisa sistemática abrangente em várias bancos de dados eletrônicos importantes (PubMed, Embase, Web of Science, Ovid, EBSCO, clinictrials.gov e Cochrane) foi feita antes de 1° de fevereiro de 2021. Os seguintes termos de pesquisa usados foram: carcinoma nasofaríngeo, imunoterapia, inibidor de checkpoint imunológico, proteína‐4 associada a linfócitos T citotóxicos ou CTLA‐4, anti‐morte celular programada‐1 ou anti‐PD‐1, ligante‐1 de morte celular programada‐1, PD‐L1 ou anti‐PD‐L1. Nenhuma restrição de idioma e de status de publicação foi imposta. Artigos adicionais relevantes foram obtidos mediante pesquisa das listas de referências dos artigos incluídos neste estudo.
Critérios de seleção dos estudos e extração de dadosDois investigadores fizeram a pesquisa bibliográfica de forma independente e de acordo com os critérios de inclusão e exclusão. As discordâncias foram resolvidas por meio de discussão e consenso ou por um terceiro investigador. Os estudos que estavam dentro dos seguintes critérios de inclusão foram considerados elegíveis para esta metanálise: (1) desenho do estudo: estudo de coorte; (2) população: carcinoma nasofaríngeo avançado; (3) intervenção do estudo: inibidor de ponto de controle imunológico em combinação com quimioterapia padrão; (4) inibidores PD‐1 de uso único ou em combinação com quimioterapia padrão; (5) desfechos mensurados: SG, SLP, TRO e eventos adversos.
Nos casos de publicações diferentes de um mesmo estudo, optou‐se por aquela com os dados completos. Dados interessantes, como o número total de pacientes e o número de pacientes com eventos claramente definidos devem ser coletados com cuidado. Além disso, os dados demográficos basais e a duração do acompanhamento foram extraídos. Os dados de cada parâmetro disponível para metanálise foram extraídos, inclusive duração média da sobrevida livre de progressão (SLP), taxa de sobrevida global em seis meses (SG6m), taxa de sobrevida global em 12 meses (SG12m), taxa de sobrevida livre de progressão em 6 meses (SLP6m), taxa de sobrevida livre de progressão em 12 meses (SLP12m), taxa de resposta objetiva (TRO), taxa de controle da doença (TCD), taxa de resposta completa (TRC), taxa de resposta parcial (TRP), taxa de estabilidade da doença (TED), taxa de progressão da doença (TPD), quaisquer eventos adversos, função hepática anormal com qualquer grau, hipotireoidismo com qualquer grau e anemia com qualquer grau em estudo de braço único. Para estudo de dois braços, parâmetros para TRO, TRC, TRP, TED, TPD, quaisquer eventos adversos, função hepática anormal com qualquer grau, hipotireoidismo com qualquer grau, anemia com Grau ≥ 3, trombocitopenia com Grau ≥ 3 e neutropenia com Grau ≥ 3 foram coletados.
Síntese e análise dos dadosO software bibliográfico Endnote (Versão 7.6, Thomson Reuters, Inc., Filadélfia, PA) foi usado para criar uma biblioteca eletrônica de citações identificadas nas pesquisas do banco de dados. As pesquisas no PubMed foram feitas com o Endnote e os registros duplicados foram excluídos. Cada estudo recebeu um código de identificação exclusivo para permitir o rastreamento das revisões e análises após a triagem do título/resumo. Dois investigadores independentes usaram uma ferramenta padronizada para extrair os seguintes dados de cada estudo: nome do primeiro autor, ano de publicação, país, número de pacientes do estudo, características basais do paciente (idade, sexo, raça, duração do diabetes) e mensurações dos desfechos. Usamos o método recomendado para avaliar o risco de viés dos estudos incluídos e os itens específicos estão apresentados na tabela 1 suplementar.
Características dos estudos incluídos
| Autor | Ano | Região | N° de pacientes | Droga anti‐PD‐1 | Desenho do estudo | Duração média de acompanhamento |
|---|---|---|---|---|---|---|
| Jin, et al. | 2021 | China Continental | 67 | Camrelizumabe, Toripalimabe, Penpulimabe, Tislelizumabe | Estudo de coorte prospectivo | 7‐meses |
| Sato, et al. | 2020 | Japão | 12 | Nivolumabe | Estudo de coorte prospectivo | 11.9‐meses |
| Shen, et al. | 2020 | China Continental | 300 | Tislelizumabe | Estudo de coorte prospectivo | 8.1‐meses |
| Ma, et al. | 2019 | China Continental | 32 | Nivolumabe | Estudo de coorte prospectivo | 7.5‐months |
| Fang, et al. | 2018 | China Continental | 93 | Camrelizumabe | Estudo de coorte prospectivo | 10‐meses |
| Ma, et al. | 2018 | Hong Kong Distrito da China | 44 | Nivolumabe | Estudo de coorte prospectivo | 12.5‐meses |
| Hsu, et al. | 2017 | TaiwanDistrito da China | 27 | Pembrolizumabe | Estudo de coorte prospectivo | 20‐meses |
Os dados foram analisados no Stata versão 12.0 (Stata Corporation, College Station, TX, EUA). Antes da sintetização dos dados, primeiro testamos a heterogeneidade entre os estudos usando a estatística I2 para descrever a porcentagem da variabilidade que é atribuída à heterogeneidade entre os estudos. O grau de heterogeneidade dos estudos com estatística I2 <50% foi considerado baixo. Estimativas combinadas foram calculadas com um modelo de efeitos fixos (método de Mantel‐Haenszel); caso contrário, um modelo de efeitos aleatórios (método de DerSimonian‐Laird) foi aplicado quando uma heterogeneidade significante entre os estudos incluídos foi encontrada. Variáveis dicotômicas foram expressas em risco relativo (RR) com intervalo de confiança de 95% (IC de 95%). A avaliação do viés de publicação foi feita com o teste de Egger e Begger. Um valor de p bicaudal inferior a 0,05 foi considerado como estatisticamente significante, exceto onde especificado de outra forma.
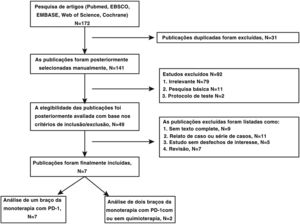
ResultadosPesquisa da literatura e descrição geral dos estudos incluídosNo total, 172 artigos foram pesquisados após a exclusão de 31 duplicações. Posteriormente, 42 artigos foram excluídos por não estarem dentro dos critérios de inclusão/exclusão. Por fim, sete artigos13,14,16–20 foram aprovados na avaliação de elegibilidade. A figura 1 mostra o diagrama de fluxo da triagem das publicações. Dados de 296 pacientes com duração de acompanhamento de até 48 meses foram agrupados e a tabela 1 mostra as características dos estudos incluídos. A tabela 2 mostra as características demográficas basais dos pacientes. A tabela 1 suplementar mostra a avaliação da qualidade da literatura, indica a compatibilidade dos estudos incluídos.
Características demográficas dos pacientes no início do estudo
| Autor | Média de idade, anos (intervalo) | Homens (%) | N° do SD do ECOG ≤1 (%) | Recorrência local (%) | Metástase (%) | N° de linhas anteriores de quimioterapia ≤2 (%) | Mediana da duração do acompanhamento do estudo, meses (interval) | Dosagem de drogas anti‐PD‐1 |
|---|---|---|---|---|---|---|---|---|
| Jin et al., 2021 | Idade ≥60 anos (%) 22 (32,8) | 50 (74,6) | 57 (85,1) | 12 (17,9) | 55 (82,1) | 57 (85,1) | 7 (2–19) | Camrelizumabe: 200‐mg a cada 2 semanas; Toripalimabe: 240‐mg a cada 3 semanas; Penpulimabe: 200‐mg a cada 2 semanas; Tislelizumabe: 200‐mg a cada 3 semanas |
| Sato et al., 2020 | 58 (30–67) | 10 (83) | 12 (100) | 8 (67) | 12 (100) | 7 (58) | 11,9 (2,8–21,7) | Nivolumabe: 3‐mg/kg a cada 2 semanas; 240‐mg a cada 2 semanas |
| Shen et al., 2020 | 56.5 (18–82) | 207 (69) | 300 (100) | NG | 284 (95) | 158 (55) | 8,1 (0,2–21,9) | Tislelizumabe: 200‐mg a cada 3 semanas |
| Ma et al., 2019 | 48 (27–72) | 31 (67,4) | 46 (100) | NG | NG | NG | 7,5 (0,8–24,7) | Nivolumabe: 3‐mg/kg a cada 2 semanas; 240‐mg a cada 2 semanas; 360‐mg a cada 3 semanas |
| Fang et al., 2018 | 45 (38–52) | 75 (81) | 93 (100) | 4 (4) | 89 (95) | 59 (64) | 9,9 (8,1–11,7) | Camrelizumabe: 200‐mg a cada 2 semanas |
| Ma et al., 2018 | 57 (37–76) | 35 (77,8) | 44 (97,8) | 13 (29,5) | 32 (70,5) | 17 (38,6) | 9,3 (3,6–13,1) | Nivolumabe: 3‐mg/kg a cada 2 semanas |
| Hsu et al., 2017 | 52 (18–68) | 21 (77,8) | 27 (100) | 9 (33,1) | 18 (66,9) | 8 (29,6) | 20 (2,2–26,8) | Pembrolizumabe: 10‐mg/kg a cada 2 semanas |
PD‐1, morte celular programada‐1; NF, não fornecido; N, número; ECOG, Eastern Cooperative Oncology Group; SD, status do desempenho.
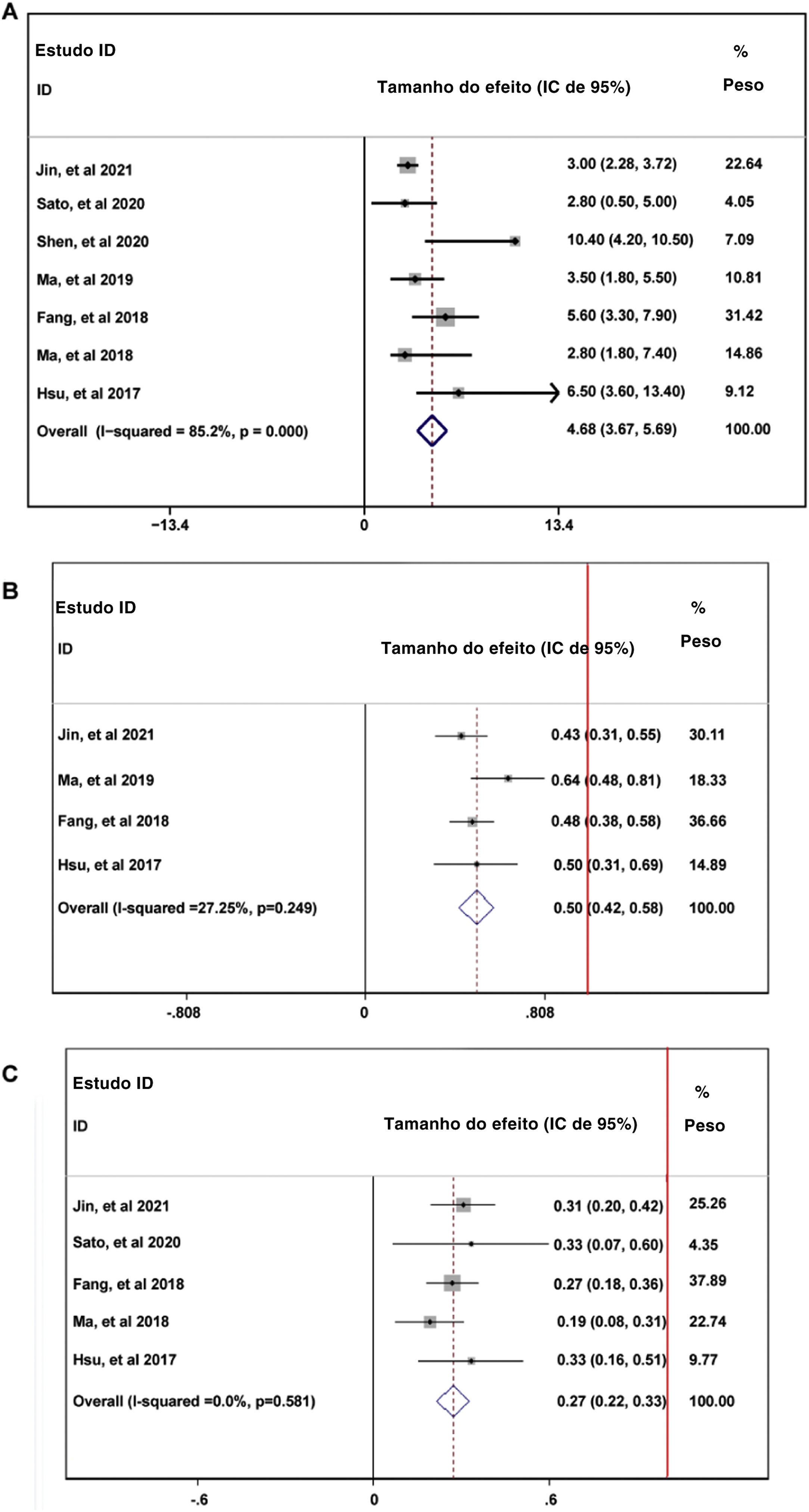
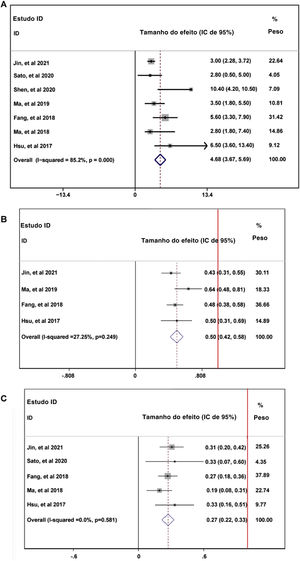
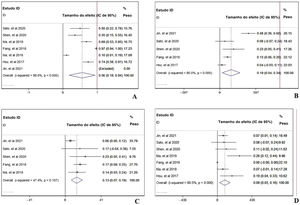
Durante o tempo de acompanhamento, os parâmetros de sobrevida livre de progressão (SLP) dos pacientes que receberam tratamento com PD‐1 — duração média de SLP (A), taxa de SLP em seis meses (B) e taxa de SLP em 12 meses — foram relatados em sete artigos sem heterogeneidade (I2 <50%).13,14,16–20 Os dados combinados indicaram que a duração média da SLP dos pacientes que receberam tratamento com inibidores de PD‐1 foi de 4,66 meses, com IC de 95%: 3,76–5,69 meses (fig. 2A). A taxa global de SLP em seis meses dos pacientes incluídos foi de 50%, com IC de 95% entre 42% e 58% (fig. 2B). No entanto, a taxa de SLP em 12 meses caiu para 27% com IC de 95%: 22%–33% (fig. 2C). Para avaliar a condição da doença em pacientes que recebiam tratamento com PD‐1, as seguintes taxas foram analisadas: TRO,13,14,16,18–20 TCD,14,16,18–20 TRC,13,14,16,18–20 TRP,13,14,16,18–20 TDS,13,14,16,18–20 e TPD13,14,16,18–20 A TRO combinada indicou a combinação de TRC e TRP foi de 25% (fig. 3A). A TCD combinada incluindo três condições da doença (RC, RP e ED) foi de 61% (fig. 3B). A TRP combinada foi de 22% (fig. 3D); no entanto, a TRC combinada foi de 2% (fig. 3C). A TED combinada foi de 33% (fig. 3E) e a TPD combinada foi de 38% (fig. 3F).
Avaliação da condição da doença em pacientes que recebiam tratamento com PD‐1: taxa de resposta objetiva (A); taxa de controle da doença (B); taxa de resposta completa (C); taxa de resposta parcial (D); taxa de estabilidade da doença (E); taxa de progressão da doença (F). A linha vertical vermelha foi apresentada como a linha de referência de x=1.
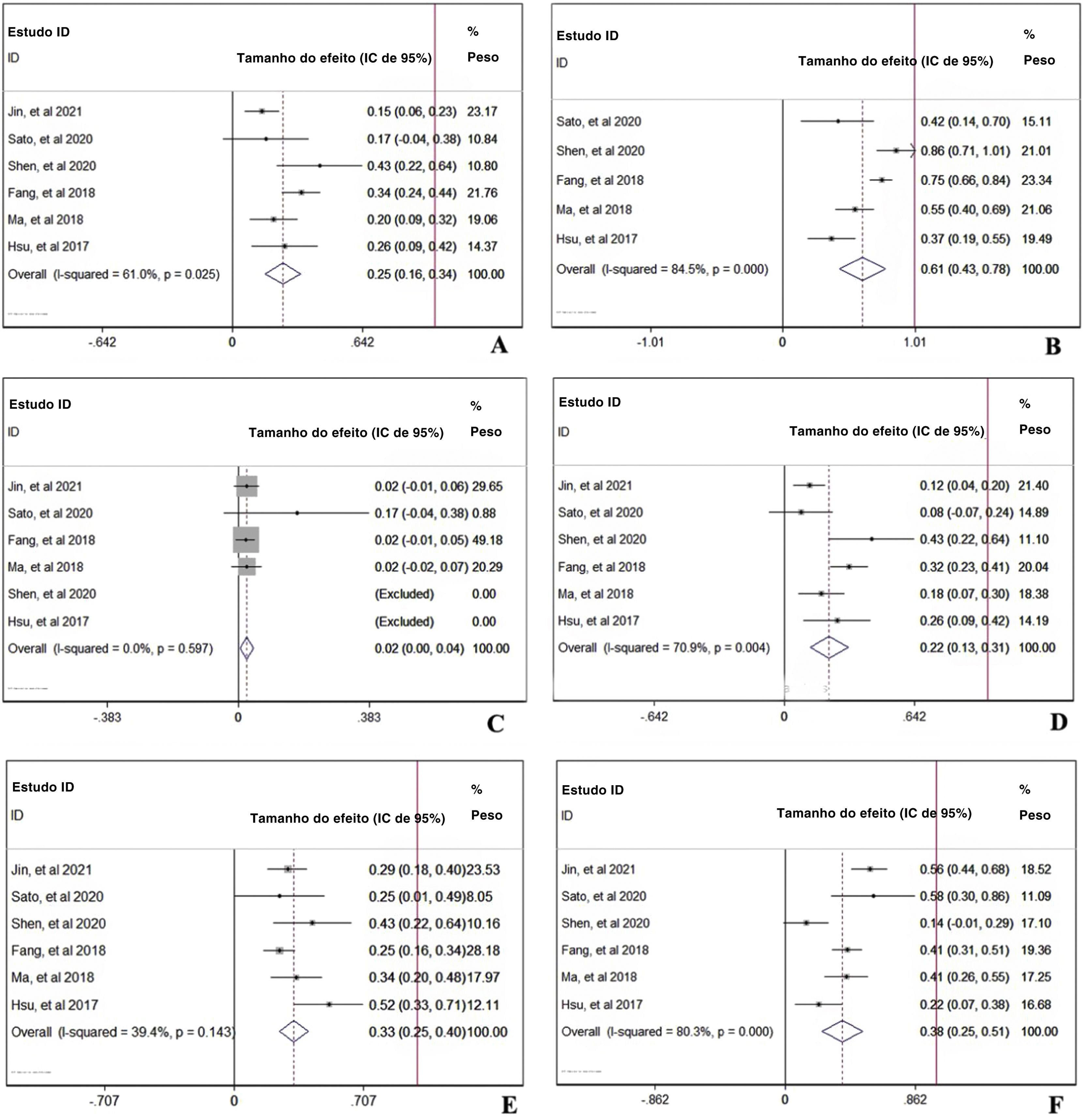
Em uma visão prospectiva, o total de eventos adversos ocorridos com qualquer grau13,14,16–20 nos pacientes tratados com PD‐1 foi de 56% com IC de 95%: 18%–94% (fig. 4A). Para investigar mais detalhadamente os três eventos adversos mais importantes, as incidências de anemia,13,14,16,19,20 função hepática anormal13,14,16,18,19 e hipotireoidismo13,14,16–20 foram analisadas. Os agrupamentos das taxas de ocorrência de anemia, função hepática anormal e hipotireoidismo foram de 19% (fig. 4B), 13% (fig. 4C) e 9% (fig. 4D), respectivamente.
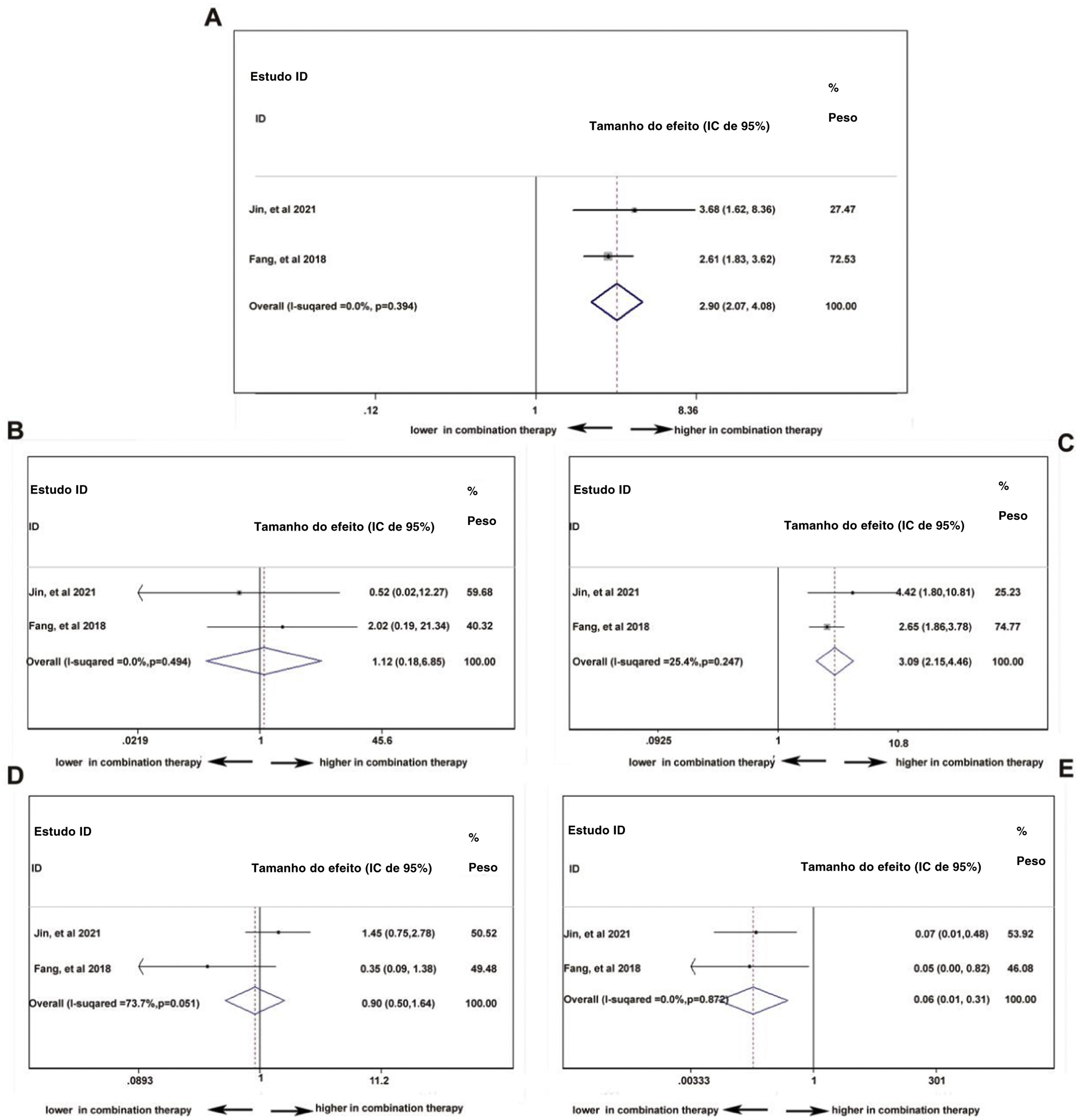
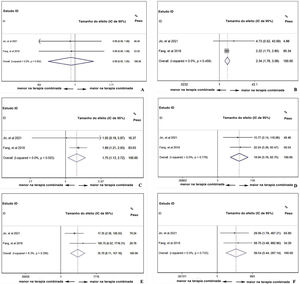
Análise de dois braços da eficácia de PD‐1: com ou sem quimioterapiaPara comparar a diferença de resposta ao tratamento entre monoterapia com PD‐1 versus PD‐1 em combinação com quimioterapia‐padrão em pacientes com CNF, os parâmetros TRO, TRC, TRP, TED e TPD13,19 foram analisados. Na figura 5A, a TRO foi maior nos pacientes com quimioterapia adicional ao tratamento com PD‐1 (TR combinada=2,90, IC de 95%: 2,07–4,08). No entanto, na figura 5B, a TRC não mostrou diferença, independentemente da existência de quimioterapia adicional ao tratamento com PD‐1 (TR combinada=1,12, IC de 95%: 0,18–6,85). A TRP foi maior nos pacientes que receberam PD‐1 em combinação com quimioterapia (TR combinada=3,09, IC de 95%: 2,15–4,46), indicou efeito cooperativo de PD‐1 e quimioterapia padrão (fig. 5C). Ao contrário, a TPD foi menor no grupo de terapia combinada (TR combinada=0,06, IC de 95%: 0,01–0,31), o que está de acordo com o resultado da TRP (fig. 5E). A condição estável do CNF foi comparável (TR combinada=0,90, IC de 95%: 0,50–1,64) com ou sem quimioterapia (fig. 5D).
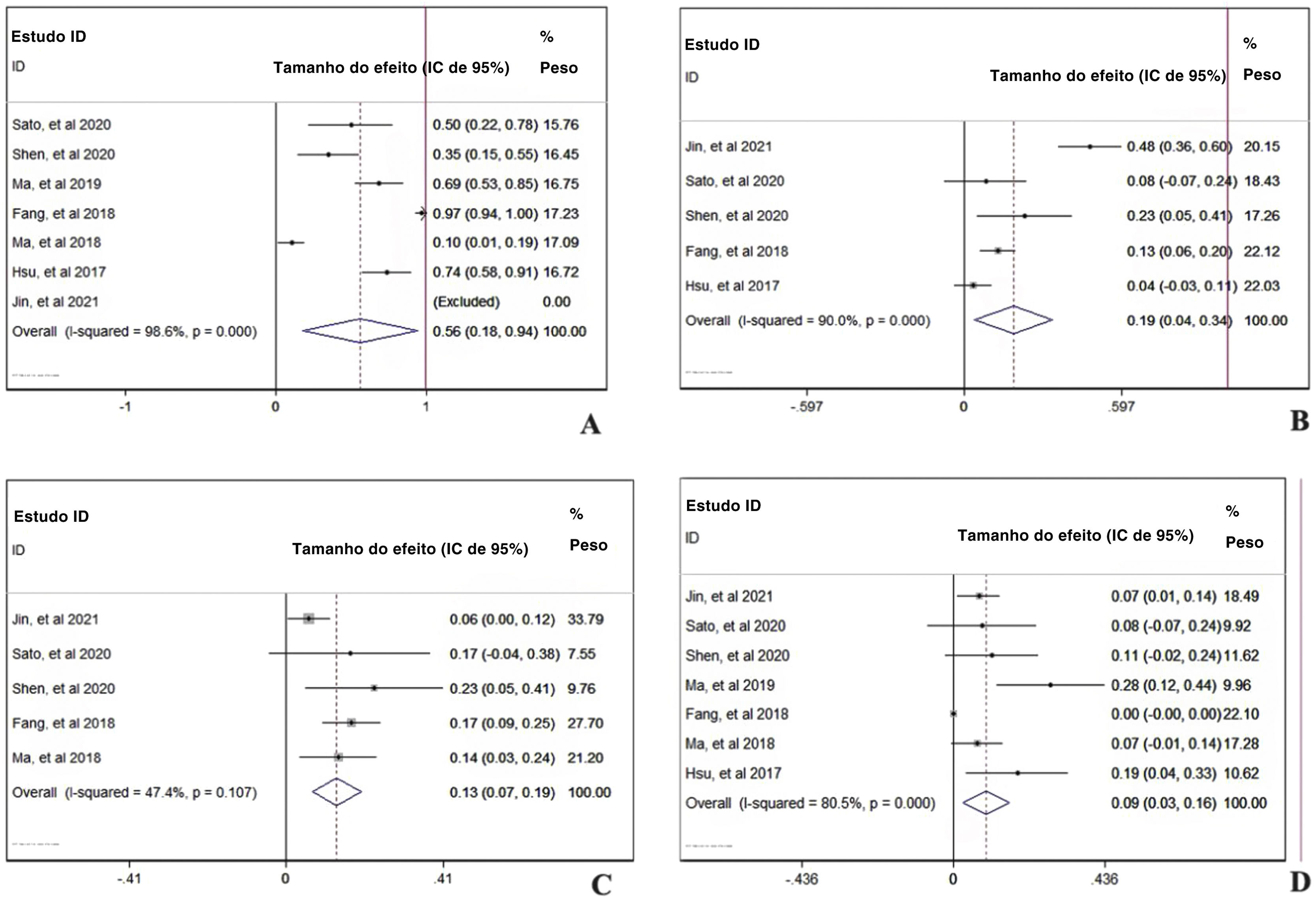
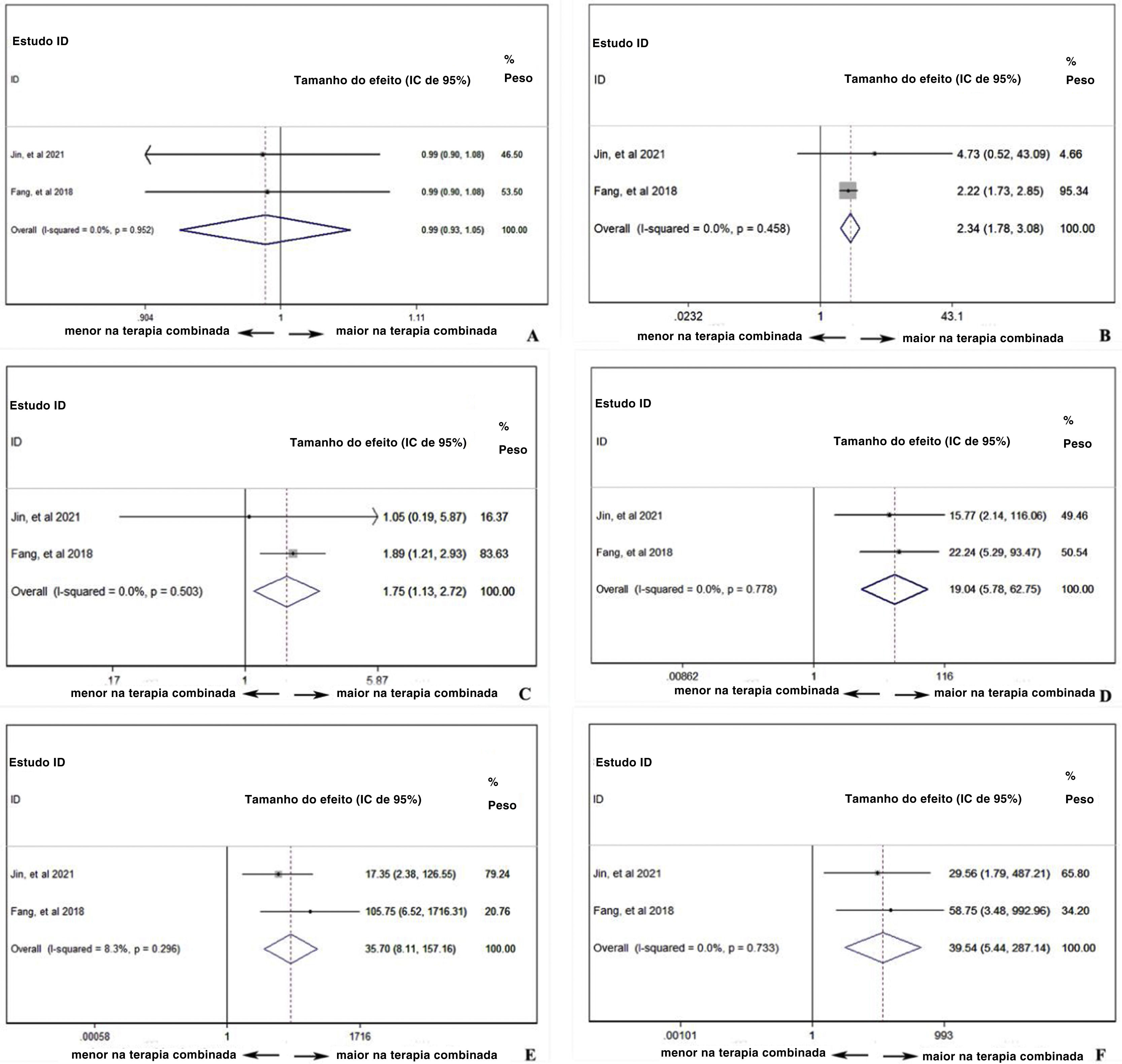
Análise de dois braços da segurança de PD‐1: com ou sem quimioterapiaO uso de PD‐1 isolado ou combinado com quimioterapia não influenciou a ocorrência de eventos adversos totais (TR combinada=0,99, IC de 95%: 0,93‐1,05), indicou que a combinação de quimioterapia e PD‐1 não adiciona risco extra de efeitos colaterais dos medicamentos (fig. 6A). No entanto, a figura 6B mostra que a combinação da terapia pode aumentar o risco de função hepática anormal com qualquer grau (TR combinada=2,34, IC de 95%: 1,78–3,08), indicando efeito cooperativo de PD‐1 e quimioterapia. Foi comprovado que o uso de PD‐1 influencia negativamente a função da tireoide e, conforme mostrado na figura 6C, a combinação de PD‐1 e quimioterapia aumentou significantemente o risco de incidência de hipotireoidismo (TR combinada=1,75, IC de 95%: 1,13–2,72). Considerando os eventos adversos graves (grau ≥ 3), anemia (fig. 6D), trombocitopenia (fig. 6E) e neutropenia (fig. 6F) foram investigadas mais detalhadamente. A taxa de ocorrência de anemia (TR combinada=19,04, IC 95%: 5,78–62,75), trombocitopenia (TR combinada=35,70, IC 95%: 8,11–157,16) e neutropenia (TR combinada=39,54, IC de 95%: 5,44– 287,14) com grau ≥ 3 foi muito maior no grupo com terapia combinada, indicou que os pacientes que receberam inibidores de PD‐1 e quimioterapia eram suscetíveis à mielossupressão.
Viés de publicaçãoO viés de publicação analisado com o teste de Begg mostrou uma distribuição simétrica das publicações incluídas (p=0,707) em um gráfico de funil (fig. 1 suplementar), indicou que não houve viés de publicação entre os artigos incluídos no presente estudo.
DiscussãoAs evidências clínicas dos inibidores de PD‐1 em pacientes com CNF vêm se acumulando. No entanto, os estudos clínicos anteriores caracterizaram‐se basicamente pelo pequeno tamanho de amostra. Este estudo fez um resumo dos estudos existentes para interpretar a condição de sobrevida em geral dos pacientes com CNF. Além disso, este estudo foi desenhado para comparar de forma abrangente a eficácia e a segurança dos inibidores de PD‐1 em pacientes com CNF, com ou sem aplicação adicional de quimioterapia padrão.
Nossa análise cobriu sete estudos independentes, variaram de 2017 a 2021. Dados de 296 pacientes com acompanhamento de até 48 meses foram agrupados. Até onde sabemos, este é o primeiro estudo sintético a comparar a eficácia e a segurança dos inibidores de PD‐1 em pacientes com CNF, com ou sem aplicação adicional de quimioterapia padrão, até o momento. Os dados de nosso estudo indicaram que a duração média da SLP no tratamento com inibidores de PD‐1 foi de 4,66 meses (IC de 95%: 3,76–5,69 meses). A taxa de SLP em seis meses foi de 50% (IC de 95%: 42%–58%); no entanto, a taxa de SLP em 12 meses caiu para 27% (IC de 95%: 22%–33%). A taxa de ocorrência dos eventos adversos totais com qualquer grau em pacientes tratados com PD‐1 foi de 56% (IC 95%: 18%–94%). Em comparação com a monoterapia com inibidor de PD‐1, a TRO foi maior na terapia combinada (TR combinada=2,90, IC de 95%: 2,07–4,08). A taxa de resposta parcial foi maior nos pacientes que receberam PD‐1 em combinação com quimioterapia (TR combinada=3,09, IC de 95%: 2,15–4,46). Ao contrário, a taxa de progressão da doença foi menor no grupo de terapia combinada (TR combinada=0,06, IC de 95%: 0,01–0,31). A taxa de estabilidade da doença foi comparável (TR combinada=0,90, IC de 95%: 0,50–1,64), com ou sem quimioterapia. O uso de PD‐1 isolado ou combinado com quimioterapia não influenciou a ocorrência total de eventos adversos (TR combinada=0,99, IC de 95%: 0,93–1,05). Contudo, a terapia combinada pode aumentar o risco de eventos adversos graves, como anemia, trombocitopenia e neutropenia.
Nos últimos anos, algumas áreas de tratamento do CNF fizeram progressões notáveis, especialmente no que se refere à biópsia líquida, cirurgia minimamente invasiva, quimioterapia e imunoterapia.21
Recentemente, uma revisão sistêmica relatou que a TRO agrupada e os eventos adversos relacionados ao medicamento foram favoráveis e gerenciáveis em pacientes com CNF que receberam tratamento anti‐PD‐1.22 Porém, esse estudo não conseguiu fazer a comparação direta dos inibidores de PD‐1 com ou sem quimioterapia tradicional. Além disso, nossa investigação atualizou os dados clínicos ao incluir mais estudos clínicos. Nos últimos anos, os avanços da terapia com inibidores de pontos de controle imunológicos melhoraram significativamente os efeitos terapêuticos do tumor maligno.5,9 O anticorpo anti‐PD‐1 mostrou forte atividade antitumoral em ensaios clínicos relativos ao CNF.12,13,20 Além disso, os efeitos sinérgicos dos inibidores de PD‐1 com quimioterapia, radioterapia, terapia de alvo molecular ou outros tipos de terapia biológica foram validados em diferentes tipos de câncer.23–27 Uma análise abrangente recente mostrou que a quimioterapia de indução é superior a somente quimioterapia concomitante para carcinoma nasofaríngeo localmente avançado.28 Contudo, os efeitos da quimioterapia de indução antes do tratamento anti‐PD‐1 não foram relatados e merecem pesquisas adicionais. Para as questões de tolerabilidade e segurança, a terapia combinada à base de inibidores de PD‐1 tem o potencial de acarretar um risco adicional que varia de leve a grave.29,30 No entanto, outros estudos relataram que os eventos adversos após o tratamento com anti‐PD‐1 não mostraram diferença tanto com quanto sem quimioterapia concomitante.13,19,22 Como a imunoterapia é incorporada ao modo de tratamento padrão, a combinação ideal de drogas direcionadas e adjuvantes imunológicos e a sequência de quimioterapia e radioterapia precisam ser resolvidas. Embora os inibidores de PD‐1 tenham mostrado uma excitante predominância no tratamento de CNF, houve relatos de alguns pacientes com CNF que responderam negativamente ao tratamento com anti‐PD‐1.31–33 Wang et al. enfatizaram o significado prognóstico da expressão de PD‐L1 e PD‐1 em pacientes com CNF, os pontos de controle imunológico do status da expressão em pacientes com CNF podem adicionar valor prognóstico ao sistema de estadiamento do tumor.34 Além disso, a expressão de PD‐1 e PD‐L1 em tecido de CNF locorregionalmente avançado apresentou correlação significativa com o desfecho da doença e a resposta à imunoterapia, inclusive eficácia e segurança.32,35–39 Além da imunoterapia direcionada ao PD‐1/PD‐L1, outros alvos do CNF foram relatados.40 Acredita‐se que o CNF esteja associado ao vírus Epstein Barr (EBV), caracterizado por infiltrado imune peritumoral.12 A imunoterapia direcionada ao antígeno EBV foi explorada em ensaios clínicos,40–42 pode se tornar um alvo importante para o CNF. Além disso, a vacina contra o câncer43–45 e a terapia celular adotiva46–48 foram exploradas em estudos clínicos.
Até onde sabemos, esta foi a primeira metanálise a comparar a eficácia e a segurança dos inibidores de PD‐1 em pacientes com CNF, com ou sem aplicação adicional de quimioterapia padrão. No presente estudo, a eficácia e a segurança dos inibidores de PD‐1 em CNF foram sumarizadas. A terapia combinada mostrou maior atividade antitumoral, exceto para o risco maior de mielossupressão. No entanto, os resultados deste estudo devem ser atualizados no futuro com mais estudos de alta qualidade.
LimitaçõesEsta metanálise incluiu sete estudos e todos com desenho de coorte prospectivo. No entanto, o desenho dos estudos não era controlado e randomizado. Além disso, alguns estudos eram pequenos e apenas alguns artigos eram elegíveis para os critérios de seleção; portanto, a análise de sensibilidade não era aplicável. Consequentemente, ensaios clínicos em grande escala, prospectivos, multicêntricos, randomizados e com relatos claros dos fatores de confusão ainda são altamente necessários.
ConclusãoO presente estudo fez um resumo dos estudos existentes para interpretar a condição de sobrevida em geral dos pacientes com CNF e para comparar de forma abrangente os inibidores de PD‐1 em CNF, com ou sem quimioterapia. A partir deste estudo, a terapia combinada de inibidores de PD‐1 e quimioterapia mostrou maior atividade antitumoral. A incidência de eventos adversos em pacientes tratados com inibidores de PD‐1 com qualquer grau não mostrou diferença tanto com quanto sem quimioterapia, exceto para o risco maior de mielossupressão.
FinanciamentoEsta pesquisa não recebeu nenhum financiamento específico de agências de fomento nos setores público, comercial ou sem fins lucrativos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Nenhum.
Como citar este artigo: Xiao L, Kang W, Liao J, Li Y. Efficacy and tolerability of immunotherapy in advanced nasopharyngeal carcinoma with or without chemotherapy: a meta‐analysis. Braz J Otorhinolaryngol. 2022;88:S70–S81.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.