Introdução: A evolução do ronco e da síndrome da apneia /hipoapneia obstrutiva do sono (SAOS) na infância ainda não está bem estabelecida e poucos estudos desses pacientes sem o tratamento cirúrgico foram publicados.
Objetivo: Avaliar a evolução da apneia e do ronco primário em crianças que não foram submetidas a cirurgia das vias aéreas superiores.
Métodos: Foram avaliadas prospectivamente 26 crianças com ronco que não haviam sido submetidas a tratamento cirúrgico. Todas foram submetidas a exame físico, nasofibroscopia e polissonografia, a partir dos quais foram divididos em dois grupos: SAOS (16 crianças) e ronco (10 crianças). Após 6 meses da avaliação inicial, os exames foram repetidos, e os dados encontrados foram comparados.
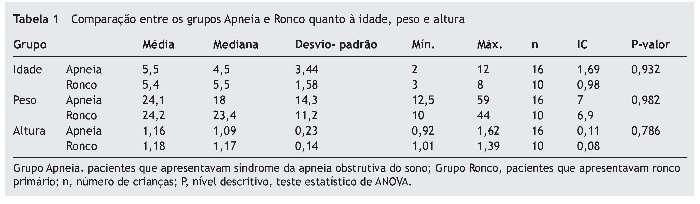
Resultados: Os grupos não apresentaram diferença entre si comparando idade, peso, altura e exame físico. Quando comparamos os resultados das duas polissonografias, houve um aumento da porcentagem do estágio do sono N1 no grupo ronco. O índice de apneia/hipoapnéeia (IAH) não apresentou alteração em ambos os grupos, o índice de distúrbios respiratórios (IDR) aumentou no grupo ronco, e o número de hipopneias diminuiu no grupo SAOS.
Conclusão: Houve aumento da porcentagem do estágio 1 do sono não-REM e do IDR nos pacientes com ronco primário; o IAH não apresentou alteração significante; o número de hipoapneias diminuiu nos pacientes com SAOS.
Introduction: The evolution of snoring and OSAS in children is not well established since few studies of patients without surgical treatment have been published.
Objective: To evaluate the evolution of sleep disordered breathing in children who had not been submitted to upper airway surgery.
Method: Twenty-six children with snoring who had not undergone upper airway surgery were evaluated prospectively. Patients were evaluated by a the full physical examination and nocturnal polysomnography, after which they were divided into 2 groups: apnea (16 children) and snoring (10 children). After 6 months following the initial evaluation, patients were submitted to a new nocturnal polysomnography, and all data were compared to those of the first examination.
Results: The groups did not show any differences regarding age, weight, height and airway physical examination. After 6 months of follow-up, the apnea index did not change, but the respiratory disturbance index increased in the snoring group and the number of hypopneas decreased in the group apnea.
Conclusion: There was an increase in the percentage of N1 sleep stage and the respiratory disturbance index in the patients with primary snore. The AHI did not show significant alteration in both groups, but the number of hypopneas decreased in patients with SAOS.
Pagina nueva Introdução
A síndrome da apneia obstrutiva do sono (SAOS), caracterizada por episódios repetidos de obstrução da via aérea superior, associados à hipóxia e hipercapnia intermitentes,1 é um distúrbio respiratório do sono que afeta tanto adultos quanto crianças. Os distúrbios respiratórios do sono (DRS) são muito comuns na infância e estima-se que de 3%-26% das crianças pequenas apresentam ronco habitual e que 1%-3% apresentam síndrome de apneia obstrutiva do sono1,2 (SAOS). Os DRS englobam o ronco primário, a síndrome do aumento da resistência das vias áreas e, como condição mais relevante, a SAOS.3
Os principais fatores de risco para SAOS na infância são hipertrofia adenoamigdaliana, obesidade, doenças neuromusculares, alterações craniofaciais e doenças genéticas.1,4-7
Dentre todos estes fatores, a hipertrofia de tonsilas palatinas e faríngea destaca-se como principal etiologia.8-10
O sintoma mais comum é o ronco habitual, sendo improvável a ocorrência da SAOS na ausência deste.11 O ronco não pode, sozinho ou associado a outros sintomas, diferenciar a SAOS do ronco primário e da síndrome da resistência aumentada das vias aéreas superiores.12
Os DRS e, principalmente, a SAOS na infância são comorbidades que podem afetar o sistema nervoso central, causando hiperatividade, sonolência diurna, déficit cognitivo e baixo rendimento escolar;13-17 o sistema cardiovascular pode alterar a pressão arterial, causando hipertrofia ventricular e disfunção endotelial;18-20 o sistema metabólico pode contribuir para a resistência a insulina, aumento de leptina, alterando a lipidemia,21,22 o crescimento e desenvolvimento.23,24
O diagnóstico da SAOS em crianças ainda apresenta diver-gências. A tentativa de utilização de combinações de sinais e sintomas para distinguir a apneia obstrutiva do ronco primário demonstrou-se ineficaz, e o exame padrão-ouro para o diagnóstico é a polissonografia.3,12,25,26
Apesar da sua importância, atualmente, a história natural do ronco e da SAOS na infância ainda não está bem estabelecida, e poucos estudos que avaliam a evolução desses pacientes sem o tratamento cirúrgico foram publicados. O ronco é um sintoma habitual e não se sabe quais crianças vão melhorar espontaneamente e quais irão evoluir para SAOS.
Ali (1993) realizou uma pesquisa através de questionário com 782 crianças para avaliar a prevalência de ronco e sintomas relacionados.27 Apósdois anos, 507 dessas crianças foram reavaliadas e, embora a prevalência de ronco habitual não apresentasse diferença, mais da metade das crianças que apresentavam ronco na primeira avaliação não apresentavam mais a queixa.2
Marcus (1998) avaliou uma coorte de 20 crianças com ronco primário, nas quais repetiu a polissonografia 1-3 anos após um primeiro exame, não encontrando variações significativas no índice de apneia e hipopneia (IAH) e nos parâmetros ventilatórios, mas duas crianças (10%) passaram a apresentar SAOS no segundo exame.18 Porém, não fica bem definido se as crianças que foram submetidas a tratamento cirúrgico antes do segundo exame foram incluídas na análise comparativa.
Topol (2001) também realizou uma coorte com 13 crianças com diagnóstico de ronco primário na polissonografia e não encontrou diferenças em novo exame após três anos.28
Anuntaseree (2001) realizou um estudo epidemiológico através de questionários com 1.088 crianças de sete anos e, em novo estudo após três anos (2005) nas crianças sem tratamento, evidenciou que houve diminuição do ronco em 65% dos casos, 4,5% das crianças sem ronco passaram a roncar, e 9% das crianças desenvolveram SAOS.29,30 Porém, a polissonografia só foi realizada em seis crianças que já apresentavam diagnóstico de SAOS no primeiro estudo e em mais sete crianças que apresentavam sintomas relacionados ao sono, o que pode ter subestimado o número de novos casos de SAOS.
Li (2010) também realizou um estudo recrutando pacientes de um estudo epidemiológico anterior e, após dois anos, reavaliou 45 crianças que apresentavam SAOS. Houve piora da SAOS em 29% das crianças, sendo que, nesse grupo de pacientes, houve um aumento na circunferência abdominal, maior prevalência de hipertrofia de tonsilas e de ronco habitual.31
Nenhum estudo prospectivo foi realizado para avaliar a evolução da SAOS e do ronco primário em pacientes que não foram submetidos a tratamento cirúrgico. Todos os estudos anteriores foram realizados através de convocação dos pacientes anos após a primeira avaliação.
O objetivo deste estudo foi avaliar a variação dos distúrbios respiratórios do sono (SAOS e Ronco Primário) em crianças que não foram submetidas à cirurgia das vias aéreas superiores.
Materiais e métodos
Foram avaliados prospectivamente 26 pacientes acompanhados no Ambulatório de Otorrinolaringologia Pediátrica com idade de 2 a 12 anos, de ambos os sexos, que apresentavam queixa de ronco ou dificuldade respiratória durante o sono e que não tinham sido submetidos à cirurgia para remoção das amígdalas e/ou adenoides ou das cavidades nasais, no período de novembro de 2009 a novembro de 2011.
Procedimento
No momento inicial, as crianças foram avaliadas pelo médico otorrinolaringologista (autor do estudo), o qual realizou a anamnese, exame físico geral e otorrinolaringológico e o exame de nasofibroscopia. Foram selecionadas todas as crianças que apresentaram história clínica de ronco habitual (mais de cinco vezes na semana por um período maior que seis meses), associados à hipertrofia de ton-silas palatinas e faríngeas e que não tinham sido submetidas a qualquer procedimento cirúrgico das vias aéreas superiores.
Os responsáveis das crianças foram orientados em relação ao estudo e assinaram o termo de consentimento, aprovado pelo Comitê de Ética protocolo 0237/10. A seguir, foram encaminhadas para realização da polissonografia noturna. Os pacientes que apresentavam queixas de rinite iniciaram tratamento com corticoide nasal antes da realização do primeiro exame de polissonografia e mantiveram o tratamento enquanto perduraram as queixas.
Todas as crianças que apresentavam indicação cirúrgica de adenoamigdalectomia foram encaminhadas para realização de exames pré-operatórios e avaliação pré-anestésica. Devido ao grande número de pacientes do serviço, a cirurgia pode demorar de seis a oito meses para ser realizada. Nesse período de acompanhamento foi solicitada uma nova polissonografia, para ser realizada seis meses após o primeiro exame. Todas as crianças foram reavaliadas antes da segunda polissonografia e nenhuma apresentou variação importante no IMC (por exemplo: sobrepeso para obesidade) ou no exame otorrinolaringológico.
Nenhum paciente teve a data da cirurgia alterada por causa do protocolo de pesquisa. Todos os pacientes que tiveram a data de cirurgia antes da realização da polissonografia foram automaticamente excluídos do estudo.
Critérios de inclusão
Ronco habitual.
Tonsilas palatinas hipertróficas.
Tonsilas faríngeas hipertróficas.
Crianças que realizaram as avaliações nos períodos préestabelecidos segundo o protocolo deste estudo (inicial e após seis meses).
Critérios de exclusão
Crianças ou responsáveis que se negaram a participar do estudo.
Não compreenderam as instruções iniciais.
Síndrome com alterações orofaciais definidas e/ou em investigação.
Doenças pulmonares, cardíacas e obesidade.
Doenças de origem metabólica ou miopática definidas e/ ou em investigação.
Crianças que não realizaram as avaliações nos períodos pré-estabelecidos segundo o protocolo deste estudo (inicial e após seis meses).
Crianças que tiveram cirurgia marcada antes da realização do segundo exame de polissonografia.
Vigência de infecção ou descompensação do quadro alérgico no momento da realização dos exames (nasofibroscopia ou polissonografia)
Exame físico
No exame físico geral avaliamos medidas de peso e altura.
No exame físico de VAS avaliamos as tonsilas palatinas e faríngeas e o índice de Mallampati modificado.
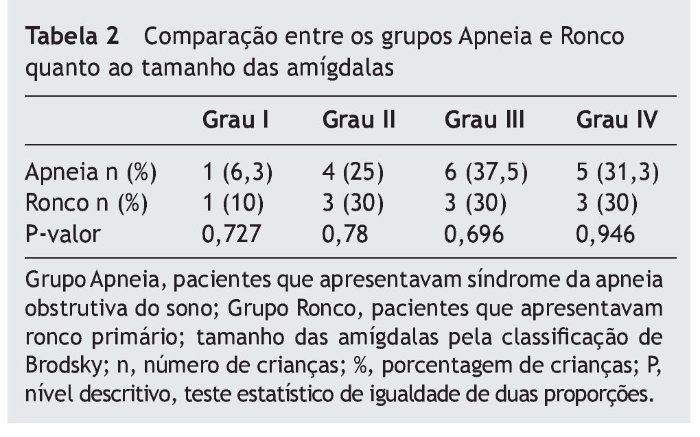
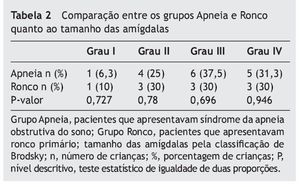
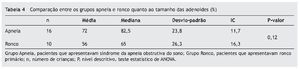
As tonsilas palatinas foram divididas em quatro graus, segundo a classificação de Brodsky:32 grau I - tonsilas estão situadas levemente fora da fossa tonsilar, ocupando menos de 25 % da área entre pilares da fossa tonsilares; grau II - tonsilas estão prontamente visíveis, ocupando 25% a 50% da área entre os pilares das fossas tonsilares; grau III - tonsilas estão ocupando 50% a 75% da área entre os pilares; e grau IV - ocupam mais de 75% da área entre os pilares.
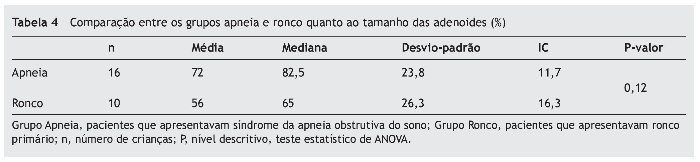
As tonsilas faríngeas foram classificadas a partir do exame de nasofibroscopia em relação à porcentagem de obstrução do cavum, sendo 0 ausência de tecido adenoideano e 100% completa obstrução.
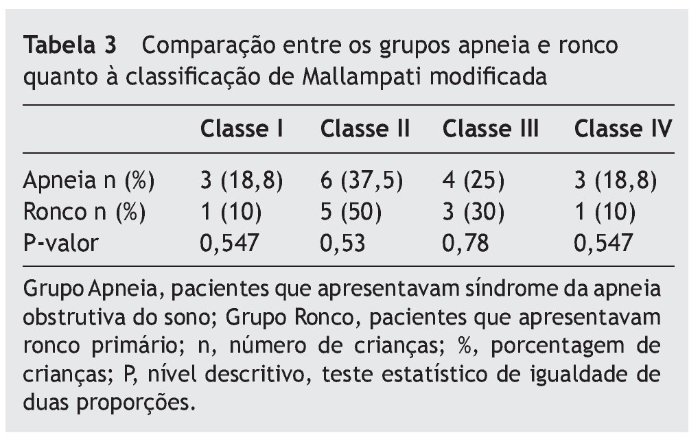
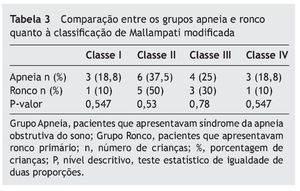
O índice de Mallampati modificado utilizado foi proposto por Friedmann,33 sendo dividido em quatro classes; na classe I é possível visualizar toda a orofaringe, incluindo o polo inferior das tonsilas palatinas; e na classe IV pode-se viasualizar apenas o palato duro e parte do palato mole, e não a parede posterior da orofaringe e nem a inserção da úvula.
Nasofibroscopia
O exame de nasofibrolaringoscopia foi realizado utilizandose fibra óptica flexível (Machida), fonte de luz de xenônio (Styker, Othobean II), câmera filmadora (Toshiba CCD IK M30AK) e monitor de vídeo (Sony KV - CR). Todos os exames foram realizados após tratamento prévio da rinite alérgica, se necessário. O exame foi realizado com a criança sentada no colo do pai ou responsável, com aplicação de spray de lidocaína 2% em ambas as fossas nasais. A fibra era introduzida em fossa nasal direita pelo meato inferior até visualização da coana. O mesmo procedimento foi realizado no lado esquerdo, porém com visualização da tonsila faríngea e da laringe.
Polissonografia
O exame de polissonografia foi realizado à noite, em quarto escuro e silencioso, com ar ambiente e na companhia do responsável. Não foram usados métodos de privação do sono ou sedação. Os parâmetros eletrofisiológicos e cardiorrespiratórios foram registrados em sistema computadorizado, utilizando dados do eletroencefalograma (F4/M1, F3/M2, C4/M1, C3/M2, O2/M1, O1/M2), eletromiograma submentoniano e tibial bilateral, eletro-oculograma direito e esquerdo, fluxo de aéreo nasal por cânula de pressão oronasal e termistor, esforço respiratório torácico e abdominal por pletismografia de indutância não calibrada, saturação de oxihemoglobina (SpO2) por oximetria de pulso, sensor de ronco (microfone) e posição no leito. Os dados foram avaliados segundo critérios do manual da Academia Americana de Medicina do Sono de 2007.34
Foi considerada SAOS: índice de apneia obstrutiva (IA) maior que um evento por hora ou índice de apneia e hipopneia obstrutiva (IAH) maior que 1,5 eventos por hora e saturação mínima de oxigênio (Nadir SpO2) menor ou igual a 92%. Os pacientes com IA menor que um evento por hora ou IAH menor que 1,5 eventos por hora e Nadir SpO2 maior que 92% com ronco foram classificados como ronco primário.35
Os pacientes foram reavaliados dentro do mesmo protocolo de atendimento e submetidos à nova polissonografia após seis meses da primeira avaliação, enquanto aguardavam pela cirurgia.
Análise estatística
Os dados obtidos foram comparados entre os dois grupos. A análise estatística foi realizada utilizando um nível de significância de 5% (0,05) e os dados foram identificados com * se houvesse significância.
Para comparação das variáveis qualitativas foi utilizado o teste de igualdades de duas proporções.
Para comparar os grupos para as variáveis quantitativas como idade, peso, altura e adenoide foi utilizado o teste de ANOVA.
Por fim, foi realizada uma análise intragrupo para os valores de polissonografia, ou seja, para a comparação dos resultados do exame inicial e após seis meses foi utilizado o teste t Student pareado (quando o mesmo sujeito é pesquisa e controle dele mesmo).
Para análise estatística foram utilizados os softwares SPSS V16, Minitab 15 e Excel Office 2007.
Resultados
No estudo, foram incluídos 26 pacientes, sendo que 16 apresentavam apneia obstrutiva do sono (Grupo Apneia) e 10, ronco primário (Grupo Ronco).
Avaliação geral dos grupos
Os grupos não apresentaram diferença entre si comparando idade, peso e altura, conforme mostra a tabela 1.
Quando comparados em relação ao exame físico otorrinolaringológico, também não apresentaram diferenças significativas entre os grupos, como mostram as tabelas 2 a 4.
Avaliação polissonográfica
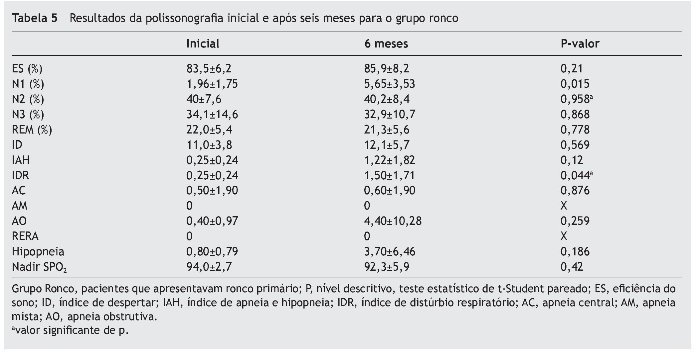
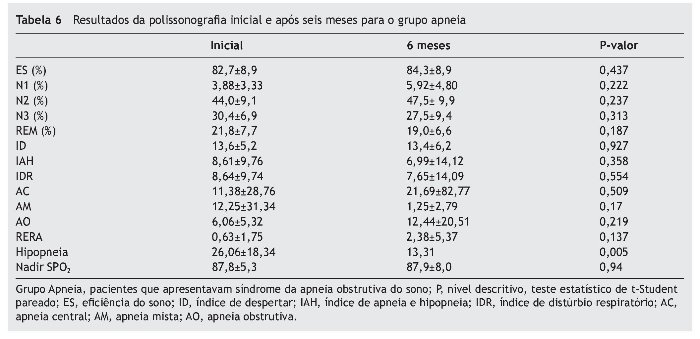
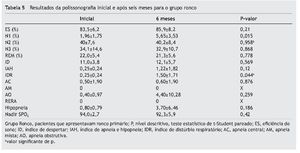
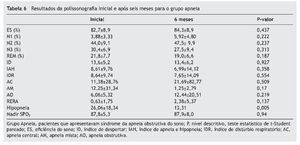
A comparação da polissonografia inicial e após seis meses em ambos os grupos está apresentada na tabela 5 para o grupo Ronco, e na tabela 6 para o grupo Apneia.
Não evidenciamos diferença estatística quanto à eficiência de sono. Houve um aumento da porcentagem do estágio do sono N1 no grupo Ronco no exame após seis meses em relação ao exame inicial, com diferença estatisticamente significante, mas essa porcentagem se manteve dentro dos limites da normalidade. Quanto à distribuição dos outros estágios do sono não houve diferença estatística quando comparados os exames inicial e após seis meses em nenhum dos grupos.
Não houve diferença estatística para comparação do índice de apneia e hhipopneia (IAH) em ambos os grupos. Também não houve diferença quando comparamos separadamente o número de apneias central, obstrutiva ou mista e quanto ao número de episódios de RERA em ambos os grupos. O número de apneia obstrutiva no grupo Ronco teve uma variação importante no desvio-padrão devido ao aumento considerável desses eventos em um dos pacientes.
Avaliando os pacientes individualmente, observamos que quatro deles do grupo Ronco (40%) passaram a apresentar SAOS pelos critérios utilizados no exame realizado após seis meses. No grupo Apneia, seis pacientes (37,5%) deixaram de apresentar SAOS pelos critérios utilizados e quatro (25%) apresentaram aumento do IAH. Dos pacientes que tiveram melhora da SAOS, dois apresentavam SAOS moderada e quatro SAOS leve na avaliação inicial.
O número de eventos hipopneia teve uma diminuição estatisticamente significante no grupo Apneia no exame após seis meses em relação ao exame inicial, apesar de o IAH não apresentar alteração estatisticamente significante.
Quanto ao índice de distúrbio respiratório (IDR), houve um aumento estatisticamente significante no grupo Ronco e não houve diferença estatística no grupo Apneia.
Quanto ao Nadir da saturação de oxigênio, não houve diferença estatística entre os momentos avaliados para ambos os grupos.
Discussão
Este estudo avaliou continuamente os pacientes para observar as variações no perfil clínico e polissonográfico de crianças com SAOS e ronco primário, o que limita o tamanho da amostra e o período estudado. Além disso, todos os pacientes com indicação para adenoamigdalectomia foram encaminhados para a cirurgia (pacientes com SAOS e aqueles com ronco e hipertrofia adenoamigdaliana sem melhora com tratamento clínico). Durante o período de avaliação não foram observadas variações importantes de IMC e exame otorrinolaringológico dos pacientes.
Quanto às alterações otorrinolaringológicas (tamanho de amígdalas e adenoides e classificação de Mallampati modificada), os grupos não apresentaram diferença estatística. Concordando com a literatura, nenhum desses dados sem o exame de polissonografia foi capaz de diferenciar os pacientes com SAOS de ronco primário.3,12,25,26
Os critérios para diagnóstico de SAOS na infância de acordo com o IAH não são padronizados em diferentes publicações científicas,18,31,36 e novos estudos ainda estão sendo realizados para estabelecer os critérios de normalidade.37-39 Avaliar a história natural da doença é fundamental na consolidação desses critérios e, principalmente, para definir quais os pacientes que precisam de um acompanhamento mais detalhado.
A arquitetura do sono é considerada preservada na maioria das crianças com SAOS, quando comparado o sono REM e não REM.10,11 Entretanto, avaliações tardias pós adenoamigdalectomia demonstraram aumento significante do sono de ondas lentas em crianças.23,40,41 Roemmich et al. evidenciaram redução significante do estágio 1 do sono acompanhada da melhora do IAH após um ano da realização da adenoamigdalectomia em crianças.42 Neste estudo, observamos um aumento significante do estágio 1 do sono não REM nos pacientes com ronco primário e, embora o mecanismo não esteja claro, a fragmentação do sono pode implicar em alterações de comportamento e baixo rendimento escolar.13-16
Quanto ao IAH não houve diferença estatisticamente significante em nenhum dos grupos. No período avaliado de seis meses podemos dizer que os pacientes não tiveram alteração na história natural da doença em nenhum dos grupos. Entretanto, avaliando os pacientes individualmente, observamos que quatro deles com ronco primário no primeiro exame (40%) apresentaram apneia no exame realizado após seis meses, mesmo sem alteração importante do IMC e exame físico, valor maior que o encontrado na literatura.18,28,30
Dos pacientes que apresentavam SAOS, quatro (25%) tiveram piora do IAH, sendo que três deles apresentavam SAOS moderada a severa no primeiro exame (IAH ≥ 5 eventos por hora). Anuntaseree et al. observaram que as crianças com SAOS apresentaram índices piores na segunda avaliação, e Li et al. também observaram piora em 29% dos pacientes com SAOS.30,31 É importante salientar que houve uma queda estatisticamente significativa no número de hipopneia dos pacientes com SAOS, mesmo não tendo interferido no IAH.
No grupo de pacientes com ronco primário, o IDR apresentou aumento estatisticamente significante, mesmo não tendo diferença no IAH e no RERA quando comparados separadamente. Introduzido mais recentemente na avaliação polissonográfica, o IDR ainda não apresenta critérios de normalidade.
É pouco provável que as diferenças encontradas sejam devido à variabilidade entre as noites de realização do exame. Um fator que poderia interferir nessa variação é a obstrução nasal causada pela rinite alérgica, mas todos os pacientes com queixas de rinite foram tratados com corticoide nasal antes dos exames. Além disso, já está bem estabelecido que uma noite de registro, desde que não ocorram intercorrências técnicas, é suficiente para identificar os DRS. Katz et al. avaliaram os resultados de polissonografias realizadas em duas noites, com intervalo de sete a 27 dias, e não observaram diferença estatística no IAH nem nas variáveis respiratórias dos pacientes, concluindo que o exame de uma única noite é adequado para mensuração da SAOS na infância.43 Li et al. compararam a polissonografia de crianças em duas noites consecutivas, concluíram que o exame de uma única noite é suficiente para identificar 84,6% dos casos de DRS.44
Não foram observadas diferenças no IAH dos pacientes quando analisados em grupos, mas quando avaliados individualmente essa variação foi determinante na escolha do tratamento. Devido aos achados desse estudo, não ocorreu uma evolução das crianças com ronco primário para SAOS no período de seis meses, mas variações individuais foram encontradas, o que reforça a necessidade de se manter o acompanhamento das crianças com DRS e estar atento a qualquer mudança no quadro clínico.
Conclusão
Após seis meses de acompanhamento de pacientes com DRS sem tratamento cirúrgico, observamos que não houve variação do DRS.
1. Houve aumento da porcentagem do estágio 1 do sono não REM e do IDR nos pacientes com ronco primário;
2. O IAH não apresentou alteração significante em ambos os grupos;
3. O número de hipopneias diminuiu nos pacientes com SAOS.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 31 de maio de 2012;
aceito em 16 de fevereiro de 2014
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2014.05.008
☆ Como citar este artigo: de Barros EL, Pradella-Hallinan M, Moreira GA, Stefanini DO, Tufik S, Fujita RR. Follow-up of obstructive sleep apnea in children. Braz J Otorhinolaryngol. 2014;80:277-84.
E-mail: emilialdebarros@yahoo.com.br (E.L. de Barros).