The guidelines on allergic rhinitis aim to update knowledge about the disease and care for affected patients. The initiative called “Allergic Rhinitis and its Impact on Asthma”, initially published in 2001 and updated in 2008 and 2010, has been very successful in disseminating information and evidence, as well as providing a classification of severity and proposing a systemized treatment protocol. In order to include the participation of other medical professionals in the treatment of allergic rhinitis, it is important to develop algorithms that accurately indicate what should and can be done regionally.
ObjectiveTo update the III Brazilian Consensus on Rhinitis – 2012, with the creation of an algorithm for allergic rhinitis management.
MethodsWe invited 24 experts nominated by the Brazilian Association of Allergy and Immunology, Brazilian Association of Otorhinolaryngology and Head and Neck Surgery and Brazilian Society of Pediatrics to update the 2012 document.
ResultsThe update of the last Brazilian Consensus on Rhinitis incorporated and adapted the relevant information published in all “Allergic Rhinitis and its Impact on Asthma” Initiative documents to the Brazilian scenario, bringing new concepts such as local allergic rhinitis, new drugs and treatment evaluation methods.
ConclusionA flowchart for allergic rhinitis treatment has been proposed.
As diretrizes sobre rinite alergica visam atualizar os conhecimentos sobre a doença e os cuidados para com esses pacientes. A iniciativa designada “Rinite Alergica e seu Impacto na Asma”, cujo relatorio inicial foi publicado em 2001 e atualizada em 2008 e 2010, tem sido muito bem sucedida na disseminaçao de informaçoes e evidencias, bem como na formulaçao da classificaçao de gravidade e proposta de sistematizaçao do tratamento. Entretanto, visando a participaçao de outros profissionais medicos no atendimento da rinite alergica, e importante o desenvolvimento de algoritmos que indiquem com precisao o que deve e pode ser feito regionalmente.
ObjetivoAtualizar o III Consenso Brasileiro sobre Rinites-2012, com elaboraçao de algoritmo para conduta da rinite alergica.
MétodoForam convidados 24 especialistas indicados pelas Associaçao Brasileira de Alergia e Imunologia, Associaçao Brasileira de Otorrinolaringologia e Cirurgia Cervico-Facial e Sociedade Brasileira de Pediatria para atualizaçao do documento de 2012.
ResultadosA atualizaçao do ultimo Consenso Brasileiro sobre Rinites, incorporou e adaptou para a realidade brasileira as informaçoes relevantes publicadas em todos os documentos da Iniciativa “Rinite Alergica e seu Impacto na Asma”, trazendo novos conceitos como a rinite alergica local, novos medicamentos e metodos de avaliaçao de tratamento.
ConclusãoProposto um fluxograma de tratamento para a rinite alergica.
Diretrizes para o tratamento da rinite alérgica (RA) desenvolvidas nos últimos 20 anos qualificaram melhor o cuidado com os pacientes. Um workshop de experts feito pela Organização Mundial de Saúde (OMS) em dezembro de 1999 deu origem a uma iniciativa designada “Rinite Alérgica e seu Impacto na Asma” (ARIA), cujo relatório inicial baseado em evidências teve quase 3.000 referências e foi publicado em 2001.1 Uma atualização do relatório ARIA foi publicada em 2008, baseada em novas evidências.2 Esse novo relatório resultou de um processo contínuo de revisão da literatura sobre aspectos anteriormente não cobertos, como, por exemplo, medicina complementar e alternativa, esportes, atualização sobre as relações entre rinite e asma, prevenção e tratamento.
No entanto, é necessária informação transparente sobre as diretrizes para facilitar a sua compreensão e aceitação. O Guia ARIA foi a primeira diretriz para doença respiratória crônica a adotar a classificação do Sistema de Graduação da Recomendação, da Avaliação, do Desenvolvimento e da Avaliação (Grade), um método avançado que tem sido adotado pela OMS. Uma nova revisão ARIA foi publicada em 2010,3 dez anos após a publicação do primeiro relatório do workshop ARIA‐OMS. A iniciativa ARIA tem sido muito bem‐sucedida na disseminação de informações e evidências, bem como na formulação de classificação de gravidade e proposta de sistematização do tratamento. Mas isso não é bastante para orientar novas práticas, especialmente quando elas demandam a participação de médicos de família, pediatras e outros profissionais de saúde. É preciso desenvolver algoritmos que indiquem com precisão o que deve e pode ser feito diante de um caso específico em sua região. Uma publicação recente de experts da iniciativa ARIA propõe um algoritmo de tomada de decisão na prática clínica para o controle da RA em adolescentes e adultos.4,5
A atualização do Consenso Brasileiro sobre Rinites – 2017 incorpora e adapta para a realidade brasileira as informações relevantes publicadas em todos os documentos da iniciativa ARIA, tal como foi feito nas versões anteriores do documento brasileiro,6,7 elaborado sempre por representantes da Associação Brasileira de Alergia e Imunologia, da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial e da Sociedade Brasileira de Pediatria.
As principais atualizações feitas no documento base de 20127 foram assim estabelecidas.
Definição de riniteRinite é a inflamação e/ou disfunção da mucosa de revestimento nasal e é caracterizada por alguns dos sintomas nasais: obstrução nasal, rinorreia anterior e posterior, espirros, prurido nasal e hiposmia. Geralmente ocorrem durante dois ou mais dias consecutivos por mais de uma hora na maioria dos dias.8
Classificação das rinitesDepende dos critérios empregados (dados clínicos, frequência e intensidade dos sintomas, citologia nasal, fatores etiológicos, fenótipos [clínica, padrão temporal, gravidade, duração, controle, resposta aos tratamentos e presença de comorbidades]).9
Em documento recente, a Academia Europeia de Alergia e Imunologia propôs a classificação das rinites crônicas com base no principal agente etiológico. É constituída por quatro subgrupos, a saber: 1) rinites infecciosas (agudas, autolimitadas, causadas por vírus e menos frequentemente por bactérias); 2) rinite alérgica (forma mais comum, induzida por inalação de alérgeno em indivíduos sensibilizados); 3) rinite não alérgica não infecciosa (grupo heterogêneo, pacientes sem sinais de infecção e sem sinais sistêmicos de inflamação alérgica. Exemplos: rinite induzida por drogas, rinite do idoso, rinite hormonal, rinite da gestação, rinite ocupacional não alérgica, rinite gustatória e rinite idiopática); e 4) rinite mista (expressão significante em pacientes com rinite crônica, com mais de um agente etiológico, conhecido ou não).10
Outro conceito recente é o do endotipo, que visa a identificar os mecanismos subjacentes envolvidos na gênese da doença e, assim, permitir tratamento direcionado e mais preciso para cada paciente.9,10 Esses endotipos são complexos e secundários a processos celulares (eosinófilos, neutrófilos e mediadores inflamatórios deles decorrentes), moleculares (IgE sérica total e específica, citocinas e quimiocinas inflamatórias), além de danos estruturais da mucosa de revestimento nasal.9,10 Assim, identificam‐se quatro endotipos de rinite: a) com resposta imunológica tipo 2; b) com resposta imunológica tipo 1; c) rinite neurogênica; d) disfunção epitelial (9). Espera‐se que a rinite mais bem caracterizada receba um tratamento individualizado, mais preciso e com maiores chances de êxito.
Rinite alérgicaA classificação da guia ARIA, baseada em frequência e intensidade dos sintomas, foi mantida por sua grande aceitação no meio médico brasileiro.1
PrevalênciaÀ semelhança do observado em várias partes do mundo, o International Study of Asthma and Allergic Diseases in Childhood feito em várias localidades do Brasil mostrou, entre crianças e adolescentes, aumento da prevalência de sintomas nasais no último ano que atingiu 37,2% (entre 26,3% e 49,9%) e 16,2% (entre 15,4% e 27,9%) para rinoconjuntivite alérgica.11
Quadro clínicoO quadro clínico continua a ser importante para o diagnóstico da rinite alérgica. Além dos sintomas característicos (espirros, prurido, rinorreia e obstrução nasal), a obtenção de histórico alérgico pessoal e familiar é fundamental, assim como a identificação dos fatores desencadeantes.12
Fatores desencadeantesEstudos nacionais reforçam a participação dos ácaros domésticos como os principais agentes etiológicos da rinite alérgica, seguidos por alérgenos de barata, epitélio de animais domésticos e mais raramente fungos.13,14 Na Região Sul do país os pólens têm importância na sensibilização de adultos e crianças.15 Reforça‐se o papel dos irritantes da mucosa com especial ênfase aos poluentes e irritantes (tabela 1).16
Fatores desencadeantes de alergias respiratórias16
| Aeroalérgenos | |
| Ácaros pó domiciliar | Dermatophagoides pteronyssinus, Dermatophagoides farinae, Blomia tropicalis |
| Baratas | Blatella germanica, Periplaneta americana |
| Fungos | Aspergillus sp, Cladosporium sp, Alternaria sp, Penicillium notatum. |
| Animais de pelo | gato, cão, coelho, cavalo e roedores (hamster, guinea pig, furão doméstico, camundongos) |
| Pólens: | gramíneas – Lolium multiflorum (azevém), Phleum pratense |
| Ocupacionais | trigo, poeira de madeira, detergentes, látex. |
| Poluentes | |
| Intradomiciliares | fumaça de cigarro, material particulado (PM 10) e dióxido de nitrogênio (NO2) derivados da combustão do gás de cozinha ou fogão a lenha. |
| Extradomiciliares | ozônio, NOx e dióxido de enxofre. |
| Irritantes | Odores fortes, perfumes, ar condicionado, produtos de limpeza |
Os alimentos raramente desencadeiam sintomas respiratórios de modo isolado. Na maioria das vezes vêm como manifestações associadas a quadros mais graves como a anafilaxia.17
FisiopatogeniaMecanismos celulares e moleculares participantes da reação alérgica e responsáveis pela inflamação alérgica são apresentados de modo a facilitar o entendimento dos diferentes endotipos de rinite propostos.9
Recursos diagnósticosDe acordo com a finalidade de avaliação eles podem ser divididos em: a) diagnóstico etiológico, b) avaliação da cavidade nasal, c) avaliação por imagem e d) avaliação complementar.
a) Diagnóstico etiológicoOs exames subsidiários mais importantes no diagnóstico etiológico da rinite alérgica, tanto pela especificidade como pela sensibilidade, são os skin prick test (SPT) e a avaliação dos níveis séricos de IgE alergenoespecífica. O diagnóstico de alergia e a identificação dos alérgenos mais relevantes em cada caso são importantes pela perspectiva de intervenções preventivas dirigidas, como o controle ambiental, pelas opções de tratamento farmacológico e, finalmente, pela opção da imunoterapia específica com alérgenos.
Os SPT com aeroalérgenos são os recursos mais usados no diagnóstico da alergia respiratória e evidenciam reações alérgicas mediadas por IgE. Devem ser executados preferencialmente com alérgenos padronizados, escolhidos de acordo com a relevância clínica pela história, idade do paciente, profissão, pelo ambiente, pela distribuição regional de alérgenos e sob a supervisão direta de médico devidamente capacitado para se evitarem os falso‐positivos e falso‐negativos e as potenciais reações sistêmicas.18 A intensidade da reação geralmente é mais reduzida nos extremos da vida e a presença de eczema extenso ou dermografismo, o uso de anti‐histamínicos orais e o uso de corticosteroides tópicos por mais de sete dias são contraindicações do teste.18
Embora níveis elevados de IgE sérica total sejam admitidos por alguns autores como sinônimo de doença alérgica, podem ser detectados também em diferentes doenças, como infecção pelo HIV, aspergilose pulmonar alérgica, sinusite fúngica alérgica, linfomas, tuberculose, parasitoses com ciclo pulmonar, entre outras. Assim, o seu valor no diagnóstico de alergias é limitado. À semelhança dos SPT, os níveis de IgE total sérica são baixos nos primeiros anos de vida.19
Por outro lado, a presença de IgE sérica específica a um determinado alérgeno é forte indicador de sensibilização alérgica, mas não deve ser valorizada na ausência de sintomas alérgicos.20,21 Tem sensibilidade e especificidade similares aos do SPT, é mais onerosa, requer punção venosa, laboratório especializado e maior tempo para obtenção do resultado. Entretanto, não sofre a interferência de medicações e das condições da pele, é isenta de risco de reações alérgicas graves, permite a avaliação de número maior de alérgenos, tem melhor reprodutibilidade e não tem interferência da técnica na feitura do exame.20
Mais recentemente, a aquisição do Component Resolved Diagnostic (CRD) permitiu a determinação de IgE específica a múltiplos alérgenos (recombinantes ou não) com o emprego da técnica de microarray (ex: Immuno Solid Phase Allergen (ISAC) e possibilitou maior precisão diagnóstica e a possibilidade de discriminar cossensibilização de sensibilização cruzada por diferentes alérgenos que apresentam a mesma proteína em sua composição.21,22
No Brasil, está disponível o ImmunoCap‐ISAC® (ThermoFisher Scientific), uma plataforma múltipla que identifica 112 componentes, naturais ou recombinantes, de 51 fontes alergênicas. O custo elevado ainda o restringe a casos muito especiais.
Apesar de os testes de provocação nasal (TPN) serem mais empregados na área de pesquisa, têm se mostrado úteis no diagnóstico de rinite alérgica, inclusive a rinite alérgica local, e de rinite não alérgica.23–25 São úteis no diagnóstico da rinite ocupacional, têm por objetivo identificar e quantificar a relevância clínica de alérgenos inaláveis ou irritantes ocupacionais.23,24 Os TPN devem ser feitos por médicos especializados, em locais apropriados e com o emprego de extratos alergênicos padronizados. Avaliação da resposta nasal pode ser feita por escore de sintomas, mas o uso de método objetivo de monitoramento é recomendado.23,24
b) Avaliação da cavidade nasalOutros exames (citologia nasal, bacterioscopia e cultura de secreções de vias aéreas, avaliação do olfato, permeabilidade nasal [rinometria acústica, rinomanometria, pico de fluxo nasal]) são usados com menor frequência.12
c) Avaliação por imagemA radiografia simples da rinofaringe é útil para o diagnóstico de obstrução nasal por hipertrofia da tonsila faríngea (adenoide) ou por outros processos tumorais da rinofaringe. A dos seios paranasais (incidências de Caldwell e Waters) não tem papel no diagnóstico da rinite alérgica.26
A tomografia computadorizada e a ressonância nuclear magnética de seios paranasais podem ser necessárias na avaliação de quadros inflamatórios e infecciosos crônicos sinusais, em complicações de quadros infecciosos agudos e na avaliação de processos tumorais benignos e malignos.26
d) Avaliação complementarSabe‐se que a rinite alérgica gera elevado impacto sobre a vida dos pacientes e de seus parentes. Recentemente foram idealizados questionários autoaplicáveis que permitem uma avaliação mais ampla dos pacientes e assim possibilitam abordagem terapêutica mais personalizada e abrangente. Entre eles destacam‐se os que avaliam distúrbios do sono e os de qualidade de vida.
Distúrbios relacionados ao sono (DRS) têm associação com fatores ambientais, sociais, culturais, biológicos, familiares e emocionais e geralmente são pouco relatados e consequentemente não valorizados e investigados.27,28 A polissonografia, considerada o padrão‐ouro para o diagnóstico de DRS, é uma avaliação objetiva, entretanto seu custo é elevado, é de difícil feitura, o que limita seu uso em estudos populacionais. Diários de sono são baratos, mas requerem tempo para preenchimento e são difíceis de interpretar.28
Recentemente, questionários escritos têm sido desenvolvidos para avaliação de DRS em diversas faixas etárias. São autoadministrados e de fácil aplicação, com custo baixo e úteis para grandes estudos.29,30 Um exemplo é o Children's Sleep Habits Questionnaire (CSQH).31 Estudo recente documentou escore significativamente maior do CSHQ em crianças com asma e/ou rinite em comparação com crianças saudáveis, em especial naquelas nas quais a doença era mal controlada.32
Outros instrumentos que têm sido cada vez mais empregados no seguimento de pacientes com rinite alérgica são os questionários de qualidade de vida em saúde (Health Related Quality of Life, HRQL), pois permitem avaliar de forma mais ampla o quanto a doença interfere no dia a dia do paciente. São curtos, autoaplicáveis, de fácil entendimento e de baixo custo.33 São exemplos desses questionários: Rhinoconjunctivitis Quality of Life Questionnaire (RQLQ),34Mini Rhinoconjunctivitis Quality of Life Questionnaire (MiniRQLQ)35 e Pediatric Rhinoconjunctivitis Quality of Life Questionnaire (PRQLQ).36
ComorbidadesAs principais comorbidades associadas à rinite alérgica são: asma, conjuntivite alérgica, rinossinusite aguda, crônica, otite média com efusão e as alterações do desenvolvimento craniofacial dos respiradores bucais em crianças, além de apneia e hipopneia obstrutiva do sono, tanto em crianças como em adultos.12
TratamentoConstam do tratamento do paciente com rinite alérgica medidas não farmacológicas e medidas farmacológicas. As medidas não farmacológicas visam a reduzir a exposição do paciente aos agentes irritantes e/ou aos quais é sensibilizado. Embora haja discussão com relação aos efeitos dessas medidas de controle ambiental sobre o controle das alergias respiratórias, elas têm sido defendidas por vários pesquisadores.37 A tabela 2 reúne as principais medidas a serem tomadas para um controle ambiental efetivo.16
Medidas de controle do ambiente16
| ‐ O quarto de dormir deve ser preferentemente bem ventilado e ensolarado. Evitar travesseiro e colchão de paina ou pena. Use os de espuma, fibra ou látex, sempre que possível envoltos em material plástico (vinil) ou em capas impermeáveis aos ácaros. O estrado da cama deve ser limpo duas vezes por mês. As roupas de cama e cobertores devem ser trocados e lavados regularmente com detergente e a altas temperaturas (>55°C) e secadas ao sol ou ar quente. Se possível a superfície dos colchões deve ser aspirada com um modelo potente de aspirador doméstico. |
| ‐ Evitar tapetes, carpetes, cortinas e almofadões. Dar preferência a pisos laváveis (cerâmica, vinil e madeira) e cortinas do tipo persianas ou de material que possa ser limpo com pano úmido. No caso de haver carpetes ou tapetes muito pesados, de difícil remoção, devem ser aspirados se possível duas vezes por semana após terem sido deixados ventilar. |
| ‐ Camas e berços não devem ser justapostos à parede. Caso não seja possível, coloque‐a junto à parede sem marcas de umidade ou a mais ensolarada. |
| ‐ Evitar bichos de pelúcia, estantes de livros, revistas, caixas de papelão ou qualquer outro local onde possam ser formadas colônias de ácaros no quarto de dormir. Substitua‐os por brinquedos de tecido para que possam ser lavados com frequência. |
| ‐ Identificar e eliminar o mofo e a umidade, principalmente no quarto de dormir, reduzir a umidade a menos de 50%. Verifique periodicamente as áreas úmidas de sua casa, como banheiro (cortinas plásticas do chuveiro, embaixo das pias etc.). A solução diluída de água sanitária pode ser aplicada nos locais mofados, até sua resolução definitiva, mesmo porque são irritantes respiratórios. É essencial investigar outras fontes de exposição aos fungos fora do domicílio (creche, escola e locais de trabalho). |
| ‐ Evitar o uso de vassouras, espanadores e aspiradores de pó comuns. Passar pano úmido diariamente na casa ou usar aspiradores de pó com filtros especiais 2x/semana. Afastar o paciente alérgico do ambiente enquanto se faz a limpeza. |
| ‐ Ambientes fechados por tempo prolongado (casa de praia ou de campo) devem ser arejados e limpos pelo menos 24 horas antes da entrada dos indivíduos com alergia respiratória. |
| ‐ Evitar animais de pelo e pena, especialmente no quarto e na cama do paciente (ambiente seguro). Manter a porta do quarto sempre fechada. Se for impossível, restringir o animal a uma única área da moradia e usar purificadores HEPA no quarto do paciente. Preferencialmente, animais de estimação para crianças alérgicas são peixes e tartarugas. |
| ‐ Evitar a exposição aos alérgenos de camundongos e ratos com intervenção profissional integrada aos cuidados de limpeza da moradia; inclusive a colocação de armadilhas, vedação de furos e rachaduras que possam atuar como pontos de entrada e a aplicação de raticida, nos casos de grandes infestações. |
| ‐ A inspeção é passo importante no extermínio de baratas. Evitar inseticidas e produtos de limpeza com forte odor, usar o método de iscas. Exterminar baratas e roedores pode ser necessário. |
| ‐ Remover o lixo e manter os alimentos fechados e acondicionados, pois esses fatores atraem os roedores. Não armazenar lixo dentro de casa. |
| ‐ Dar preferência às pastas e aos sabões em pó para limpeza de banheiro e cozinha. Evitar talcos, perfumes, desodorantes, principalmente na forma de sprays. |
| ‐ Não fumar e nem deixar que fumem dentro da casa e do automóvel. O tabagismo pré‐natal, perinatal e pós‐natal está associado a problemas respiratórios futuros na prole. |
| ‐ Evitar banhos extremamente quentes e oscilação brusca de temperatura. A temperatura ideal da água é a temperatura corporal. |
| ‐ Dar preferência à vida ao ar livre. Esportes podem e devem ser praticados, evitar dias com alta exposição aos pólens ou poluentes em determinadas áreas geográficas. |
| ‐ Recomenda‐se aos pacientes alérgicos ao pólen manter as janelas da casa e do carro fechadas durante o dia, abri‐las à noite (menor contagem de pólens). Os sistemas de ventilação de casa e do carro devem ser equipados com filtros especiais para pólens. Máscaras protetoras e óculos são úteis. Os pólens podem ser transportados para dentro de casa nas roupas e em animais domésticos. Evite deixar as roupas para secar ao ar livre, se possível use secadora automática. |
| ‐ Evitar atividades externas nos períodos de alta contagem de pólens, entre 5h e 10h e em dias secos, quentes e com ventos. |
| ‐ Manter os filtros dos aparelhos de ar condicionado sempre limpos. Se possível limpe‐os mensalmente. Evitar a exposição a temperatura ambiente muito baixa e oscilações bruscas de temperatura. Lembrar que o ar condicionado é seco e pode ser irritante. |
Como medidas farmacológicas destacamos as diferentes classes de medicamentos habitualmente usados na abordagem terapêutica dos pacientes com rinite alérgica: anti‐histamínicos H1 isolados (anti‐H1; sistêmicos ou tópicos), descongestionantes (sistêmico, tópico nasal), corticosteroides (sistêmico, tópico nasal), cromoglicato dissódico, antagonistas de receptores de leucotrienos. Além desses, a solução salina, a imunoterapia alergenoespecífica e, mais recentemente, agentes imunobiológicos têm composto o arsenal terapêutico de pacientes com rinite alérgica.12
Os anti‐H1 são considerados medicamentos de primeira linha no tratamento da RA, sobretudo os de segunda geração ou não clássicos.2,3,7 Por atuar sobre o receptor H1da histamina, aliviam de forma eficaz os sintomas da fase imediata da RA, como o prurido nasal, os espirros, a rinorreia e os sintomas oculares associados, e parcialmente o bloqueio nasal, característico da fase tardia da doença.38 Por serem menos lipofílicos e terem baixa passagem pela barreira hematoencefálica, fixam‐se pouco aos receptores H1 cerebrais e consequentemente causam menos efeitos adversos sobre o sistema nervoso central como sedação.39
Os anti‐H1 de segunda geração tem início rápido de ação e são medicamentos para uso por tempo variável (uma a quatro semanas), podem também ser usados por tempo prolongado em casos moderados‐graves e persistentes. Em virtude de seu excelente perfil de segurança e vantagens terapêuticas no tratamento da rinite alérgica, os anti‐H1 de segunda geração devem ser sempre priorizados em relação aos compostos mais antigos para todas as faixas etárias.40–42
Além das formulações orais, atualmente são disponíveis anti‐histamínicos para uso tópico nasal e ocular. Os anti‐H1 tópicos nasais têm eficácia similar aos compostos orais e apresentam como vantagem terapêutica início de ação mais rápido e maior efetividade no controle da obstrução nasal.43–45
Os descongestionantes nasais são estimulantes adrenérgicos ou adrenomiméticos, cuja ação principal é a vasoconstrição, produzem alívio rápido do bloqueio nasal na rinite alérgica.46 De acordo com a via de aplicação, são divididos em dois grupos: oral e tópico nasal. A pseudoefedrina é o descongestionante oral mais usado, seguido pela fenilefrina. No Brasil, só estão disponíveis em combinação com anti‐H1. A pseudoefedrina deve ser usada com cautela em função de sua ação psicotrópica e de seus potenciais efeitos colaterais cardiovasculares. Não é recomendada para pacientes menores de quatro anos, pelo maior risco de toxicidade, e as formulações de liberação prolongada com doses de 120mg não são recomendadas para menores de 12 anos.46,47 Os descongestionantes tópicos nasais devem ser usados no máximo por até 5‐7 dias, pois o uso prolongado aumenta o risco de rinite medicamentosa, muitas vezes de difícil resolução. Além disso, podem causar efeitos cardiovasculares importantes, assim como no sistema nervoso central (derivados imidazólicos), são contraindicados em crianças menores de seis anos. Também devem ser evitados em idosos, em função da maior incidência de hipertensão e retenção urinária com seu uso nessa faixa etária.46
A associação de oximetazolina e furoato de mometasona para uso tópico nasal acompanhou‐se por início rápido de ação, melhor eficácia sobre o bloqueio nasal e redução do tamanho dos pólipos, em pacientes com rinite alérgica sazonal e polipose nasal, em comparação com os fármacos administrados de forma isolada.48,49
Os corticosteroides, potentes agentes anti‐inflamatórios, têm sido muito usados no tratamento de várias doenças, inclusive as alérgicas. Em pacientes com rinite alérgica os corticosteroides sistêmicos são reservados a pacientes com exacerbações graves ou formas graves de rinite alérgica sempre por curto período (cinco a sete dias) para prevenção de efeitos adversos decorrentes do uso prolongado.2,12 Entretanto, a administração parenteral de corticosteroides (conhecidos como de depósito; ação prolongada) é proscrita no manejo da rinite, em especial em crianças e idosos, devido aos efeitos adversos sistêmicos.12 Estudo recente avaliou a ação da associação desloratadina (0,5mg/mL) e prednisolona (4mg/mL) durante sete dias em crianças (dois a 12 anos) em crise aguda grave de rinite alérgica e documentou controle significativo dos sintomas nas primeiras 24 horas de tratamento, acompanhada por menor incidência de eventos adversos, sobretudo sonolência.50
Já os corticosteroides tópicos nasais (CN) apresentam perfil de segurança mais amplo, o que possibilita seu uso por períodos de tempo mais prolongados e são o tratamento anti‐inflamatório de escolha advogado pela maioria dos especialistas que tratam a rinite alérgica (de várias sociedades médicas1–3,8,12,51). Os corticosteroides tópicos nasais também têm se mostrado efetivos no controle de rinites ocupacional, gestacional e idiopática.51
Os CN melhoram a congestão nasal, a alteração do olfato, a coriza, os espirros, o prurido nasal e os sintomas oculares associados, esses últimos por possível ação no reflexo naso‐ocular (rinoconjuntivite alérgica). Seu uso leva a melhoria na qualidade de vida, na qualidade de sono e na concentração diurna. O tratamento com CN reduz também o risco de complicações como a rinossinusite, a otite secretora e a asma.1,2,12
No Brasil as formulações de CN disponíveis são: dipropionato de beclometasona (BDP), budesonida (BUD), propionato de fluticasona (FP), furoato de mometasona (MF), furoato de fluticasona (FF) e ciclesonida (CIC). Os CN liberados para uso em maiores de dois anos são o MF e o FF; para maiores de quatro anos a BUD e o FP enquanto que acima dos seis anos são o BDP e a CIC.12 O início da ação dos CN ocorre em sete a 12 horas após sua administração, mas os pacientes devem ser notificados de que o efeito terapêutico final pode demorar até 14 dias para ser atingido.12,51 Embora todos tenham ação anti‐inflamatória, diferem em suas características farmacodinâmicas e farmacocinéticas, o que lhes garante diferentes perfis de segurança.51
Estudos mostram que o efeito terapêutico dos CN depende não apenas da efetividade da substância ativa, mas também da deposição do produto na cavidade nasal (spray ou aerossol),51,52 de sua afinidade pelo receptor de glicocorticoide e da relação concentração‐tempo no local da atuação e a lipofilia é fator importantes no efeito terapêutico e no do potencial de atingir a circulac¿a¿o siste¿mica (disponibilidade sistêmica) e da sua eliminação.51,52 Acredita‐se que o CN ideal deveria apresentar alta lipofilia, baixa disponibilidade sistêmica e elevado clearance sistêmico.52,53
Os efeitos adversos dos CN são, em sua maioria, dependentes da disponibilidade sérica, que é diminuída pela capacidade do fármaco de ligar‐se a proteínas plasmáticas. A nova geração de CN exibe alta afinidade de ligação às proteínas plasmáticas: FF, FM e CIC ligam‐se em 99%; FP em 90%, BUD em 88% e DPB em 87%, o que afeta sua biodisponibilidade sistêmica.53,54
Os principais efeitos adversos relacionados ao uso de CN são locais (irritação local, sangramento, perfuração septal), podem ser observados com qualquer dos produtos usados e são dependentes da dose usada e da técnica de aplicação. Em relação aos efeitos adversos sistêmicos (interferência sobre o eixo hipotálamo‐hipófise‐adrenal, efeitos oculares, efeitos sobre o crescimento, reabsorção óssea e efeitos cutâneos), podem ocorrer segundo a idade do paciente, a dose usada e a farmacocinética do produto.53,54
Embora sejam apontados como seguros, mesmo em pequena escala, todos os CN são absorvidos sistemicamente em alguma porção e podem exibir efeitos adversos. Os efeitos dos CN em crianças e em gestantes são semelhantes aos observados em pacientes adultos.54 Entretanto, o uso dos CN em gestantes exige maior ponderação, uma vez que há sempre a preocupação com a embriogênese. A BUD é o único CN que entra na categoria B para uso na gravidez, com a ressalva da prescrição na menor dose e tempo possíveis.55
A associação de anti‐H1 (cloridato de azelastina) e CN (propionato de fluticasona) para uso tópico, em dispositivo único, incialmente indicada para pacientes maiores de 12 anos, com sintomas persistentes moderados ou graves e sem controle com anti‐H1 e/ou CN,55–58 mostrou‐se eficaz e segura em crianças a partir dos quatro anos.59,60
Estudos em pacientes com rinite alérgica compararam o tratamento com a associação e os componentes administrados de modo isolado e revelaram ser a associação mais efetiva no controle desses pacientes,55–60 sem perda de sua ação mesmo quando administrados por tempo prolongado.61 A incidência de eventos adversos tem sido similar à observada com os pacientes tratados com placebo. Até o momento não há dados suficientes sobre segurança de seu uso em mulheres grávidas ou em amamentação.55,61
O cromoglicato dissódico tem ação estabilizadora sobre a membrana de mastócitos e, consequentemente, impede a ação dos mediadores químicos liberados por essas células durante a reação alérgica. São superiores ao placebo, porém muito menos eficazes quando comparados com aos anti‐H1 e os CN, no controle da rinorreia, dos espirros e do prurido nasal, além de pouco atuar sobre a obstrução.2,62 Apresenta excelente perfil de segurança, torna‐se uma opção terapêutica aceitável em lactentes, faixa etária em que os CN não são liberados.2,62 Devido à sua curta meia‐vida, deve ser administrado de quatro a seis vezes ao dia, o que dificulta a adesão ao tratamento.
O montelucaste sódico (MS) é o único composto representante dos antagonistas de receptores de leucotrienos existente no Brasil. Tem superioridade reconhecida ao placebo no controle dos sintomas e na melhoria da qualidade de vida de pacientes com rinite alérgica.63–65 Embora o MS não seja a primeira escolha para o tratamento de pacientes com rinite alérgica, tem sido apontado como uma opção terapêutica para os pacientes com asma e rinite alérgica concomitante66 e naqueles com dificuldade de adesão aos regimes de tratamento com medicação tópica nasal. Além disso, podem ser considerados nos casos de rinossinusite crônica com polipose nasal, na doença respiratória exacerbada por aspirina (AERD).
Recentemente uma associação entre um anti‐H1 (levocetirizine 5 mg + montelucaste de sódio 10 mg) para indivíduos maiores de 18 anos foi disponibilizada para uso.67 Estudos em adultos mostram que a terapia combinada é superior a ambas as medicações quando administradas de modo isolado.68–70
A imunoterapia alergenoespecífica (ITE) permanece como o único tratamento modificador da doença alérgica.71 Além disso, proporciona benefícios duradouros após a sua descontinuação,72 previne a progressão da doença, inclusive o desenvolvimento de asma,73,74 bem como o desenvolvimento de novas sensibilizações.75–77
A ITE é recomendada no tratamento de adultos e crianças (> 5 anos) com rinite alérgica moderada/grave intermitente e em todas as formas persistentes,77 sempre por especialista em alergologia. A indicação da ITE deve estar fundamentada na comprovação da sensibilização alergenoespecífica por métodos in vivo ou in vitro, na relevância do(s) alérgeno(s) no desencadeamento de sintomas, na impossibilidade de evitar a exposição ao(s) alérgeno(s) e na disponibilidade de extrato alergênico padronizado e comprovadamente eficaz.12,78 É procedimento terapêutico de longa duração.
São contraindicações absolutas de ITE: asma não controlada, doença autoimune ativa, neoplasia maligna, crianças menores de dois anos e pacientes com infecção pelo vírus da imunodeficiência humana (HIV). São contraindicações relativas: asma parcialmente controlada, doença autoimune em remissão, uso de betabloqueadores, doenças cardiovasculares, crianças entre dois e cinco anos, infecção pelo HIV (classificação A e B; CD4 > 200 células/mm3), infecções crônicas, imunodeficiências e uso de imunossupressores.79
A lavagem nasal com soluções salinas tem sido empregada como coadjuvante no tratamento de afecções nasais agudas e crônicas. Por ser método barato, prático e bem tolerado tornou‐se muito difundido. O uso da solução salina facilita a remoção de secreções, promove consequentemente alívio sintomático aos pacientes.51 No caso específico das rinites inflamatórias e alérgicas, a lavagem nasal também promove a remoção de mediadores inflamatórios presentes no muco nasal, atua assim na melhoria do quadro.51 A solução salina isotônica deve ser usada 1‐2x ao dia, como tratamento adjuvante na rinite alérgica.80 A observação clínica recomenda a lavagem nasal prévia antes da aplicação de outros medicamentos tópicos nasais.
Agentes biológicos (anticorpos monoclonais humanos ou humanizados) desenvolvidos para o tratamento da asma grave têm sido usados, com bons resultados, em outras doenças, como urticária crônica, rinossinusite crônica, polipose nasal e rinite alérgica. Sintetizados por organismos vivos e direcionados contra um determinante específico, por exemplo, uma citocina ou seu receptor.81 A identificação de diferentes vias moleculares que têm significado clínico contribuiu para estabelecer os alvos do tratamento e levou à identificação dos endotipos descritos em asmáticos e que poderiam muito bem ser transferidos à rinite alérgica.82
Em doenças alérgicas os alvos contra os quais foram desenvolvidos agentes biológicos são: IgE, citocinas promotoras de resposta Th2, como IL‐4, IL‐5, IL‐9, IL‐13, IL‐31, e TSLP, receptor para quimiocinas CCR4 e moléculas de superfície e adesão CD2, CD11a, CD20, CD25, CD52 e ligante OX40. No entanto, há poucas evidências de uso de biológicos em rinite alérgica.
Metanálise avaliou a eficácia e segurança de omalizumabe em pacientes com rinite alérgica não controlada e o associou de modo significante a alívio de sintomas, redução do consumo de medicação de resgate e melhoria da qualidade de vida nesses pacientes.83 O omalizumabe é, em geral, bem tolerado e a sua readministração não é seguida pela formação de anticorpos contra a medicação, portanto não se mostrou imunogênico.84 Além disso, a adição de anti‐IgE à imunoterapia alérgeno específica reduziu o índice de reações sistêmicas à ITE.85–87
Biológicos, inclusive anti‐IL‐5 (mepolizumabe, reslizumabe) e anti‐IL4/13 (dupilumabe), foram estudados em pacientes com diferentes condições, mas a eficácia não ocorreu em todos os pacientes. O alvo desses biológicos são moléculas específicas que participam dos mecanismos patogenéticos da asma, rinite, dermatite atópica e rinossinusite crônica.88 O que se espera é o controle das doenças pela redução da inflamação imunológica e da produção de anticorpos IgE. Há necessidade de estudos delineados para avaliar a ação desses recursos terapêuticos com desfecho primário na rinite alérgica.89
Avaliação do controle clínicoDe modo semelhante ao observado em diversas doenças crônicas, como a asma e a urticária crônica, o conceito de controle clínico na rinite tem sido valorizado nos últimos anos. Esse conceito pode ser definido como o nível no qual os objetivos do manejo da doença são alcançados pelo tratamento instituído.90
Diferentemente do nível de gravidade da doença, critério classicamente empregado para definir o tratamento da rinite,2 o controle da rinite parece ser um critério mais adequado para nortear o seu tratamento.90 Entretanto, a avaliação do controle da doença deve ser personalizada e nada substitui o adequado seguimento da rinite alérgica no contexto da relação médico‐paciente. Diversos instrumentos foram desenvolvidos com o objetivo de auxiliar a avaliação do controle da rinite por médicos e/ou atuar na triagem de pacientes não controlados na atenção primária.90,91 Entre eles destacam‐se a escala visual analógica (EVA) e questionários/escores de avaliação. A EVA foi recentemente proposta por algumas organizações e sociedades médicas como ferramenta para a autoavaliação rotineira do paciente e como método auxiliar no manejo do tratamento farmacológico.4,92,93
Os questionários/escores de avaliação de controle, propostos mais recentemente, diferem no enfoque dado ao conceito de controle, ora abordam mais intensamente os sintomas da doença, ora valorizam o impacto das consequências da rinite nas atividades e na vida diária. Além disso, observam‐se questionários específicos para a avaliação da rinite e questionários que abordam simultaneamente a rinite e a asma. Entre esses destacam‐se: Rhinitis Control Assessment Test (RCAT),94,95Rhinitis Control Scoring System (RCSS)96 e Allergic Rhinitis Control Test.97 O Control of Allergic Rhinitis and Asthma Test (CARAT) foi idealizado para avaliar conjuntamente o controle de pacientes com asma e rinite em adolescentes e adultos98 e o Control of Allergic Rhinitis and Asthma Test – Kids (CARATkids) para crianças de seis a 12 anos.99
Tratamento cirúrgicoO tratamento cirúrgico na rinite alérgica tem por finalidade corrigir as alterações anatômicas nasossinusais crônicas associadas. Isso é especialmente válido para pacientes com obstrução nasal refratária ao tratamento clínico e que apresentam hipertrofia da concha inferior.41 Os benefícios relatados por estudos observacionais indicam potencial melhoria da respiração e consequente melhoria na qualidade de vida, assim como a melhor distribuição dos medicamentos tópicos na cavidade nasal.40
Até o momento, nenhuma técnica foi estabelecida como padrão‐ouro. A seleção da técnica a ser empregada é individualizada e depende de fatores como, por exemplo, maior ou menor componente ósseo ou mucoso da concha inferior, experiência do cirurgião, equipamentos disponíveis, custo, entre outros.100
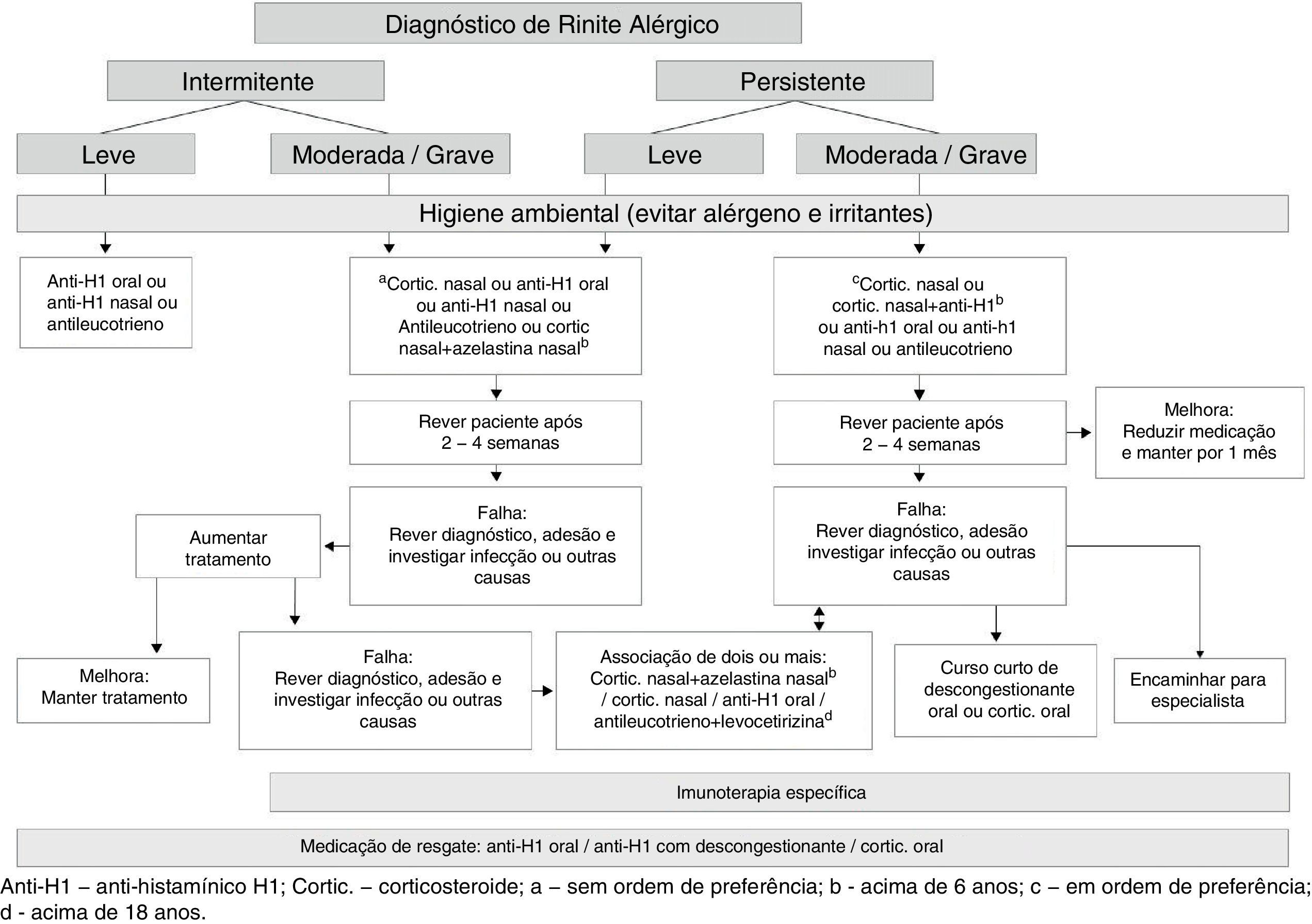
Considerações finaisCom base nas recomendações para tratamento da rinite alérgica publicadas pela iniciativa ARIA2,4,5 e pela Academia Europeia de Alergia e Imunologia, Americana de Asma, Alergia e Imunologia9 e Americana de Otorrinolaringologia,40 propusemos o fluxograma para o tratamento (figura 1).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sakano E, Sarinho ES, Cruz AA, Pastorino AC, Tamashiro E, Kuschnir F, et al. IV Brazilian Consensus on Rhinitis – an update on allergic rhinitis. Braz J Otorhinolaryngol. 2018;84:3–14.
Documento de posição conjunta da Associação Brasileira de Alergia e Imunologia, da Associação Brasileira de Otorrinolaringologia e Cirurgia Crânio‐Facial e da Sociedade Brasileira de Pediatria.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.