O implante coclear é um método de tratamento eficaz para a perda auditiva grave a profunda. Muitos fatores que podem influenciar o sucesso do implante coclear foram explicados em estudos anteriores. Além desses fatores, pequenas diferenças no tamanho dos nervos cocleares normais podem afetar o desempenho pós‐operatório.
ObjetivoInvestigar se pequenas diferenças no tamanho dos nervos cocleares normais afetam o desempenho pós‐operatório do implante coclear.
MétodoForam incluídos neste estudo 30 pacientes pediátricos surdos pré‐linguais, tratados com implante coclear. A partir de imagens de ressonância magnética parassagitais reconstruídas, foram medidos o diâmetro e a área de seção transversal do nervo coclear no lado ipsilateral e contralateral. As avaliações auditivas foram feitas 1, 3, 6 e 12 meses após a primeira adaptação. Todas as análises foram feitas com a ferramenta EARS® (do inglês evaluation of auditory responses to speech). A correlação entre o diâmetro do nervo coclear, a área transversal e a percepção auditiva pós‐operatória foi analisada para determinar se a variação no tamanho do nervo coclear contribui para o desempenho auditivo pós‐operatório.
ResultadosO diâmetro médio do nervo coclear no lado ipsilateral foi de 718,4μm (504,5 a 904,3μm) e a área da seção transversal média foi de 0,015 cm2 (0,012‐0,018 cm2). No lado contralateral, o diâmetro médio do nervo coclear foi de 714,4μm (502,6 a 951,4μm) e a área da seção transversal média foi de 0,014 cm2 (0,011 a 0,019 cm2). A correlação entre o diâmetro e a área transversal do nervo coclear ipsilateral e contralateral não revelou qualquer significância. O escore médio do teste monosyllable‐trochee‐polysyllable no primeiro mês, denominado MTP1, foi de 0,17 (0,08‐0,33), no sexto mês com teste de 6 palavras, MTP6, foi de 0,72 (0,39‐1,0), no sexto mês com 12 palavras, MTP12, foi de 0,46 (0,17‐0,75) e no 12° mês com 12 palavras, MTP12, foi de 0,73 (0,25‐1,0). Não houve correlação entre os valores do teste monosyllable‐trochee‐polysyllable em qualquer momento com o diâmetro do nervo coclear ipsilateral. Entretanto, o teste monosyllable‐trochee‐polysyllable do primeiro mês, do 6° mês, e o do 12° mês correlacionaram‐se com a área transversal do nervo coclear ipsilateral.
ConclusãoMedir a área da secção transversal do nervo coclear de aparência normal pode fornecer conhecimento prognóstico importante sobre os resultados do implante coclear. Em pacientes com área da secção transversal maior, o desempenho auditivo foi melhor e mais rápido. Embora o nervo coclear pareça normal, pequenas diferenças na área da secção transversal do nervo coclear podem afetar o desempenho, de forma que a medida do tamanho do nervo coclear nas imagens de ressonância magnética na projeção parassagital pode fornecer informações benéficas sobre o processo de reabilitação pós‐operatória.
O implante coclear é um método de tratamento eficaz para pessoas com perda auditiva grave a profunda, introduzindo sinais diretamente nos neurônios do gânglio espiral que transfere os impulsos para o nervo coclear. O principal resultado esperado do implante coclear é obter habilidades de fala e linguagem normais ou quase normais em crianças surdas pré‐linguais e alcançar audição normal em indivíduos surdos pós‐linguais. Mas os resultados esperados podem diferir de acordo com fatores individuais e treinamento e educação pós‐implante.1–3
Muitos fatores que podem influenciar o sucesso do implante coclear foram explicados em estudos anteriores. Entre esses, são descritos a presença de deficiências adicionais4 influências dos pais, status socioeconômico, envolvimento dos cuidadores no curso de educação, escolaridade materna,5–7 prematuridade, baixo peso ao nascer, hospitalização em unidade de terapia intensiva e intubação.8 Black et al. estudaram diferentes variáveis, como idade no momento do implante, família, problemas adicionais e complicações durante a cirurgia, sexo, mutação GJB2, meningite, malformações da orelha interna e prematuridade, em seu estudo de revisão e observaram que os únicos fatores prognósticos significantes eram malformações da orelha interna, influência da família e implante tardio.9 Em geral, pacientes com intervenção precoce e uso anterior de aparelhos auditivos têm melhor prognóstico.10,11
Como não existe um método preciso para determinar o resultado dos implantes cocleares, os pacientes devem ser avaliados em detalhes quanto à candidatura. Malformações cocleares, anormalidades do nervo coclear e ossificação da cóclea são distúrbios bem estudados que podem aumentar a probabilidade de um prognóstico ruim devido a resultados altamente variáveis.12,13 Um dos casos mais desafiadores entre essas malformações é a anormalidade do nervo coclear. A ressonância magnética (RM) de alta resolução tem sido tradicionalmente usada para identificação de anormalidades do nervo coclear. O diâmetro do nervo coclear foi analisado em vários estudos. Morita et al. mediram os diâmetros do nervo coclear a partir de imagens axiais de RM em candidatos a implante coclear e os correlacionaram com resultados pós‐operatórios e demonstraram que pacientes com nervos maiores tiveram melhor desempenho.14 As medidas das imagens na RM parassagital foram feitas em diferentes estudos, produziram achados mais precisos.15,16 Sildiroglu et al. calcularam a área da seção transversal do nervo coclear em pacientes idosos com perda auditiva neurossensorial e não encontraram alterações significantes no tamanho do nervo coclear.17 Russo et al. encontraram hipoplasia leve do nervo coclear em crianças com perda auditiva profunda na RM.18 Em um estudo mais recente, Chung et al. verificaram que pacientes com nervo coclear deficiente ou canal ósseo estreito do nervo coclear apresentaram resultados ruins do implante coclear.19 O nervo facial foi usado anteriormente para avaliar comparativamente o tamanho do nervo coclear e, como referência rápida, a relação nervo facial/nervo coclear pode ser usada para avaliar anomalias do nervo coclear.20 Entretanto, há dados limitados sobre o efeito de pequenas diferenças no tamanho do nervo coclear nos nervos cocleares não hipoplásicos ou deficientes em relação ao desempenho pós‐operatório do implante coclear. Em um estudo em que o implante coclear foi feito em pacientes com surdez pós‐lingual, a área da seção transversal do nervo coclear foi correlacionada positivamente com o desempenho auditivo.21 Mesmo que o nervo coclear seja hipoplásico, os pacientes podem se beneficiar dos implantes cocleares. A presença de nervo coclear na RM e nenhuma outra anomalia que acompanhe a perda auditiva foram associadas a melhores resultados auditivos.22
Portanto, neste estudo, objetivamos medir o diâmetro e a área transversal dos nervos cocleares com aparência normal em pacientes que receberam implantes cocleares e analisar a relação entre o tamanho do nervo coclear e o desempenho pós‐operatório, o que pode ajudar a prever os resultados do implante coclear.
MétodoConsiderações éticasO estudo foi feito no departamento de otorrinolaringologia após aprovação pelo comitê de ética institucional (número 279851). O consentimento informado foi obtido dos pais de todos os pacientes. Os dados e imagens dos pacientes foram armazenados nos prontuários eletrônicos dos pacientes e analisados retrospectivamente.
PacientesOs prontuários médicos de 180 pacientes pediátricos surdos bilaterais pré‐linguais que receberam implantes cocleares entre 2011 e 2015 foram revisados retrospectivamente para exames otorrinolaringológicos, exames auditivos pré‐operatórios, TC e RM de ossos temporais. Todos os pacientes apresentavam perda auditiva congênita e, no exame pré‐operatório de potencial evocado auditivo de tronco encefálico (PEATE), nenhum dos pacientes apresentou onda bilateral 5 a 90dB nHL. Foram excluídos pacientes com seguimento inferior a um ano, prontuários incompletos, imagens indisponíveis, anomalia da orelha interna, inserção incompleta de eletrodos e complicações pós‐operatórias. Após as exclusões, foram incluídos no estudo 30 pacientes que apresentavam nervos cocleares não hipoplásicos ou aplásicos na RM quando comparados ao nervo facial. Vinte dos pacientes eram do sexo masculino e 10 eram do feminino, com entre 11 e 56 meses no momento do implante, com média de 19,2 meses.
Todos os nossos pacientes foram testados por métodos eletrofisiológicos e comportamentais. Todos os indivíduos foram testados primeiro com emissões otoacústicas por produtos de distorção (EOAPD), seguidos de estímulo chirp e chirp de banda estreita e testes de PEATE. Os implantes cocleares foram aplicados em pacientes cujas EOAPD não puderam ser obtidas e cujos valores limiares não foram obtidos na intensidade acima de 90dB NAn no teste PEATE (nenhum limiar foi obtido no PEATE ósseo). Os testes comportamentais foram feitos em pacientes que podiam cooperar, para determinar os limiares auditivos por audiometria de observação comportamental (BOA, do inglês behavioral observation audiometry) ou audiometria de reforço visual (VRA, do inglês visual reinforcement audiometry) da audiometria lúdica. A decisão sobre o implante coclear foi tomada em pacientes que não demonstraram limiar acima de 90dB na faixa de 500 a 4.000Hz nos testes comportamentais. De acordo com os achados audiológicos e a mão dominante dos pacientes, decidiu‐se sobre qual orelha a ser operada.
Após avaliação auditiva pré‐operatória abrangente e imagens de CT e RM dos ossos temporais, foi tomada a decisão de implante coclear e sob anestesia geral, o implante coclear padrão foi feito sob anestesia geral por mastoidectomia e inserção de janela redonda. A maioria dos pacientes recebeu implante de orelha direita (n=29, 96,6%). Os implantes cocleares foram Nucleus ™ em 11 pacientes, Medel ™ em 11 pacientes e Clarion ™ em 8 pacientes.
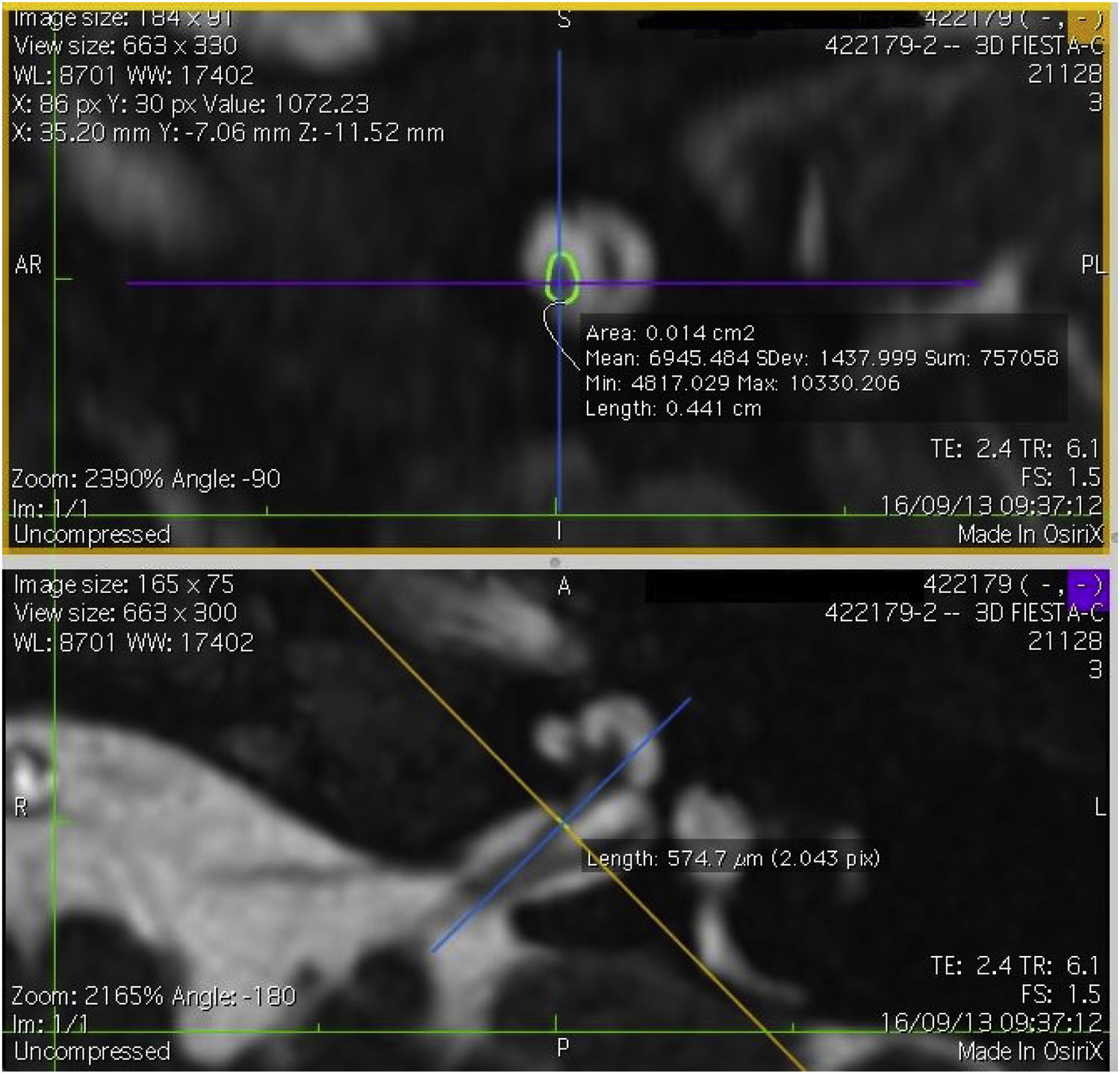
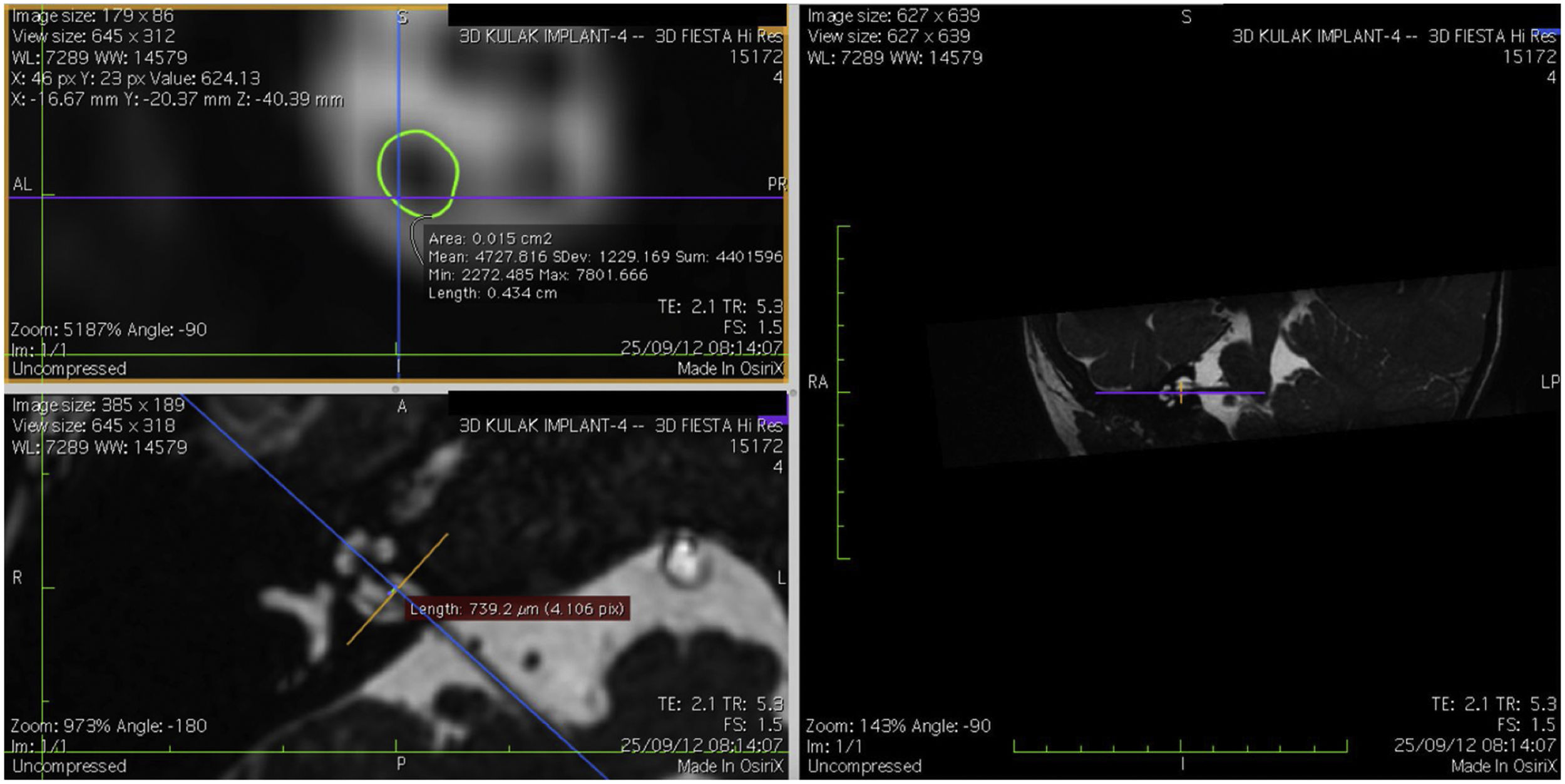
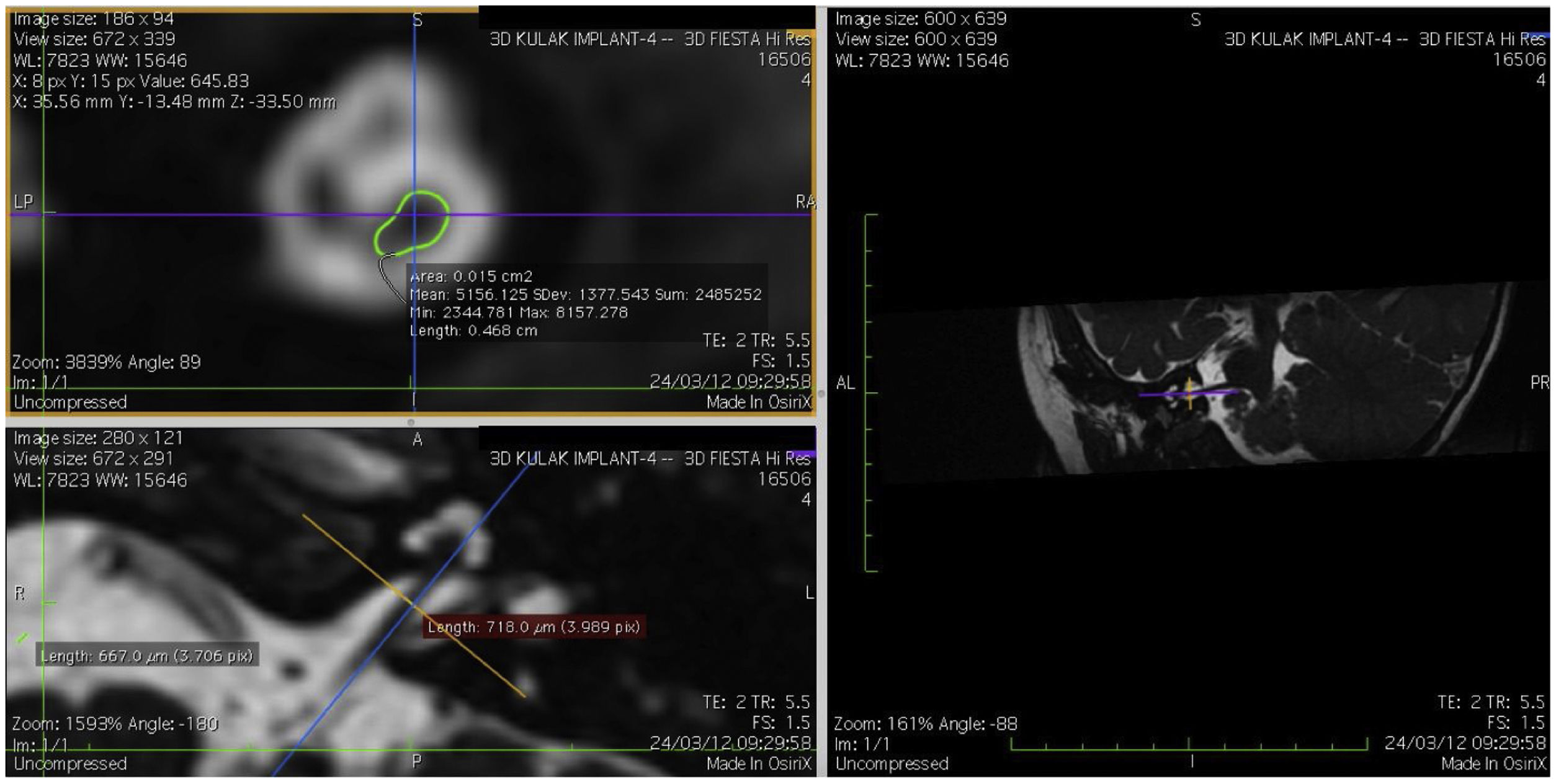
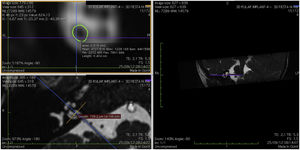
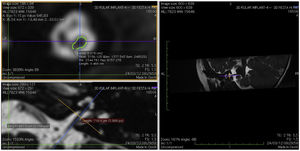
Imagem e medida do nervo coclearTodos os pacientes foram submetidos a CT e RM do osso temporal no Departamento de Neurorradiologia. O exame convencional do cérebro e do ouvido interno foi feito com um scanner 3T MR. Foram adquiridas imagens de alta resolução com uso da sequência 3D CISS (Constructive Images in Steady State) de RM do osso temporal. Nessa sequência, os dados foram adquiridos com um campo de visão de 160mm, espessura de corte de 1,5mm e uma matriz de imagem de 192×512. As imagens da sequência CISS foram transferidas para o software Macintosh Osirix™ para análise. Após a identificação do canal acústico interno nas imagens axiais, as imagens reformatadas parassagitais foram criadas pelo modo de reformatação 3D multiplanar (MPR 3D) do programa OsiriX. As imagens reformatadas eram perpendiculares ao eixo longo do conduto auditivo interno (CAI), do ponto de saída do nervo coclear até a cóclea, que demonstrava as imagens axiais reais do nervo. Do ponto de vista axial, os planos sagital e coronal foram movidos sobre o CAI e as imagens foram rotacionadas de modo que o eixo de rotação fosse perpendicular ao CAI. Os cálculos foram feitos no ponto médio do nervo coclear a partir do ponto de saída da cóclea e do ponto de entrada no tronco encefálico, tanto no lado ipsilateral quanto no contralateral. Os diâmetros horizontais do nervo coclear foram medidos nas imagens parassagitais reformatadas e foram usados para calcular a área da seção transversal do nervo por dois radiologistas diferentes, separadamente, e o valor médio das diferentes medidas foi usado.
Avaliação do resultado auditivoAs avaliações auditivas foram feitas um, 3, 6 e 12 meses após a primeira adaptação. Todas as análises foram feitas com a ferramenta EARS® (Evaluation of Auditory Responses to Speech), implantada por Dianne J. Allum‐Mecklenburg em 1995.23 A ferramenta de avaliação contém vários testes de fala e questionários e foi adaptada para mais de 20 idiomas desde sua primeira apresentação em 1996. Essa ferramenta é adequada para crianças de um a 18 anos. A partir desta ferramenta de teste, a versão em turco do monosyllable‐trochee‐polysyllable test (MTP) com reconhecimento de palavras com uma, duas ou três sílabas com 6 ou 12 palavras (MTP6 e MTP12 respectivamente) e o monosyllable closed‐set test feito com palavras dissílabas (BIS12) foram usados.
Monosyllable‐Trochee‐Polysyllable test (MTP)Após o ajuste, os pacientes foram avaliados no 1°, 6° e 12° meses. Testes com 3, 6 e 12 figuras foram aplicados no 1°, 6° e 12° meses, respectivamente. Cada palavra foi repetida e avaliada 4 vezes no teste de 3 palavras (total de 12 pontos), 3 vezes no teste de 6 palavras (total de 18 pontos) e 2 vezes no teste de 12 palavras (total de 24 pontos). Para a análise estatística, os pontos foram convertidos em valores percentuais.24,25 Os pacientes também foram avaliados como aprovados ou não aprovados, de acordo com a taxa de sucesso de 70% em cada teste.
Monosyllable closed‐set test feito com palavras dissílabas (BIS12)Esse teste, que foi usado pela primeira vez por Schneider et al.,26 foi feito com 12 figuras com palavras dissílabas e avaliado em mais de 24 pontos. Os pontos foram então convertidos em valores percentuais para análise estatística.
Análise estatísticaOs dados registrados do diâmetro do nervo coclear e da área de seção transversal foram importados para o pacote estatístico SPSS 22.0 (SPSS, Inc., Chicago, IL). O teste de Kolmogorov‐Smirnov foi usado para comparar as distribuições dos dados com distribuição normal. O teste U de Mann‐Whitney foi usado para a análise dos dados quantitativos. O teste de Wilcoxon foi feito para analisar medidas repetidas. A correlação de Spearman foi calculada para determinar a correlação entre o diâmetro do NC, a área da seção transversal e outros parâmetros. Um valor de p <0,05 foi considerado estatisticamente significante.
ResultadosOs nervos cocleares de 60 orelhas de 30 pacientes foram medidos com imagens parassagitais reformatadas no software OsiriX. As figuras mostram a imagem reformatada e o local do diâmetro calculado do nervo coclear (figs. 1, 2 e 3). Os dados demográficos, média, mediana e desvio‐padrão das medidas do nervo coclear dos lados ipsilateral e contralateral e os resultados do teste EARS são apresentados na tabela 1.
Dados demográficos, média, mediana e desvio‐padrão das medidas do nervo coclear dos lados ipsilateral e contralateral e resultados do teste EARS
| Mín‐máx | Mediana | Média±DP, n (%) | ||
|---|---|---|---|---|
| Idade no implante (meses) | 11,00−56,00 | 16 | 19,10±9,10 | |
| Sexo | ||||
| Feminino | 10 | 0.33 | ||
| Masculino | 20 | 0.67 | ||
| Lado do implante | ||||
| Direito | 29 | 0.97 | ||
| Esquerdo | 1 | 0.03 | ||
| Teste MTP 1omês | 0,08−0,33 | 0,17 | 0,17±0,09 | |
| 6° | ||||
| Falhou | 14 | 0,47 | ||
| Passou | 16 | 0,53 | ||
| Teste MTP 6omês ‐ MTP6 | 0,39−1,00 | 0,67 | 0,72±0,16 | |
| Teste MTP 6omês ‐ MTP12 | 0,17−0,75 | 0,38 | 0,46±0,17 | |
| 12° | ||||
| Falhou | 5 | 0,17 | ||
| Passou | 25 | 0,83 | ||
| Teste MTP 12omês ‐ MTP12 | 0,25−1,00 | 0,75 | 0,73±0,19 | |
| Teste BIS12 12omês | 0,13−0,92 | 0,58 | 0,57±0,23 | |
| Nervo coclear | ||||
| Diâmetro ipsilateral (μm) | 504,50−904,30 | 718,4 | 699,75±106,71 | |
| Diâmetro contralateral (μm) | 502,60−951,40 | 714,4 | 704,30±114,18 | |
| Área ipsilateral (cm2) | 0,012−0,018 | 0,015 | 0,015±0,001 | |
| Área contralateral (cm2) | 0,011−0,019 | 0,015 | 0,014±0,002 |
Quando o diâmetro do lado ipsilateral foi comparado ao diâmetro do nervo coclear contralateral, não houve diferença significante entre as medidas. O diâmetro médio do nervo coclear no lado ipsilateral foi de 699,75±106,71μm (504,5‐904,3μm) e a média da área da seção transversal foi de 0,015cm2 (0,012‐0,018cm2). No lado contralateral, o diâmetro médio do nervo coclear foi de 704,30±114,18μm (502,6‐951,4μm) e a AST média foi de 0,014±0,002cm2 (0,011‐0,019cm2) (tabela 2). A correlação entre o diâmetro e a área transversal do nervo coclear ipsilateral e contralateral e a idade no momento do implante não mostrou significância (p > 0,05) (diâmetro ipsilateral e contralateral versus idade: p=0,55 e p=0,98, respectivamente, r=0,13 e r=0,003, respectivamente).
Diâmetro ipsilateral e contralateral e área da seção transversal dos nervos cocleares
| Nervo coclear | Mín−Máx | Mediana | Média±DP | p |
|---|---|---|---|---|
| Diâmetro ipsilateral (μm) | 504,50−904,30 | 718,4 | 699,75±106,71 | 0,79 |
| Diâmetro contralateral (μm) | 502,60−951,40 | 714,4 | 704,30±114,18 | |
| Área ipsilateral (cm2) | 0,012−0,018 | 0,015 | 0,015±0,001 | 0,36 |
| Área contralateral (cm2) | 0,011−0,019 | 0,015 | 0,014±0,002 |
Teste de Wilcoxon.
Nos testes MTP com palavras de uma, duas e três sílabas no 1°, 3°, 6° e 12° meses após o ajuste, os resultados foram os seguintes: escore médio no MTP do 1° mês (MTP1) foi de 0,17 (0,08‐0,33), no 6° mês com teste de 6 palavras (6° mês MTP6) foi de 0,72 (0,39‐1,0), no 6° mês com teste de 12 palavras (6° mês MTP 12) foi de 0,46 (0,17‐0,75) e no 12° mês com 12 palavras (12° mês MTP12) foi de 0,73 (0,25‐1,0) (tabela 3). As correlações entre os valores de MTP foram significantes entre MTP1, MTP6, MTP12 no 6° mês e MTP12 no 12° mês (p=0, 0, 0,003, r=0,765, 0,78, e 0,608, respectivamente), MTP12 no 6° mês, MTP12 no 6° mês e MTP12 no 12° mês (p=0 e 0, r=0,989 e 0,779, respectivamente (tabela 3.) A análise de correlação também detectou que, embora não significantes, os valores do MTP foram correlacionados inversamente com a idade de implantação (quanto melhor o MTP, menor a idade de implantação) (idade de implantação vs. MTP1, MTP6, MTP12 no 6° mês e MTP12 no 12° mês, p=0,621, 0,157, 0,097, 0,09, r=‐0,115, ‐0,32, ‐0,37, ‐0,38, respectivamente).
Correlações de valores do teste MTP. Valores em negrito são dados significativos
| Correlações | MTP no 1o mês | MTP no 6° mês ‐ MTP6 | MTP no 6° mês ‐ MTP12 | MTP no 12° mês‐ MTP12 |
|---|---|---|---|---|
| MTP no 1° mês | ||||
| r | 1 | 0,765 | 0,78 | 0,608 |
| p | , | 0 | 0 | 0,003 |
| MTP no 6° mês ‐ MTP6 | ||||
| r | 0,765 | 1 | 0,989 | 0,754 |
| p | 0 | , | 0 | 0 |
| MTP no 6° mês ‐ MTP12 | ||||
| r | 0,78 | 0,989 | 1 | 0,779 |
| p | 0 | 0 | , | 0 |
| MTP no 12° mês‐ MTP12 | ||||
| r | 0,608 | 0,754 | 0,779 | 1 |
| p | 0,003 | 0 | 0 | , |
Não houve correlação entre os valores de MTP em nenhum momento com o diâmetro do nervo coclear ipsilateral. No entanto, o MTP no 1° mês, o MTP6 no 6° mês e o MTP12 no 12° mês correlacionaram‐se com a área transversal do nervo coclear ipsilateral (p=0,012, 0,034, 0,046 e r=0,53, 0,46, 0,43, respectivamente) (tabela 4). Embora não tenham se correlacionado significantemente, os resultados do teste BIS12 foram melhores em pacientes com maior AST (p=0,066, r=0,4).
Correlações entre os valores dos testes MTP e BIS e diâmetro do nervo coclear ipsilateral e a área de seção transversal. Valores em negrito indicam dados significativos
| Ipsilateral | ||
|---|---|---|
| Diâmetro | Área | |
| MTP no 1° mês | ||
| r | 0,13 | 0,53 |
| p | 0,55 | 0,012 |
| MTP no 6° mês ‐ MTP6 | ||
| r | 0,13 | 0,46 |
| p | 0,56 | 0,034 |
| MTP no 6° mês ‐ MTP12 | ||
| r | 0,14 | 0,43 |
| p | 0,54 | 0,052 |
| MTP no 12° mês‐ MTP12 | ||
| r | 0,11 | 0,43 |
| p | 0,61 | 0,046 |
| BIS12 no 12° mês | ||
| r | 0,05 | 0,4 |
| p | 0,81 | 0,066 |
Quando os resultados do teste MTP foram convertidos em não aprovação e aprovação de acordo com a taxa de sucesso de 70%, os valores da MTP6 no 6° mês não diferiram significantemente para o diâmetro do nervo coclear ipsilateral, mas foram significantemente diferentes para a área transversal do nervo coclear ipsilateral (tabela 5) (p=0,32 e 0,012, respectivamente). No teste MTP12 no 12° mês, não houve diferença significante entre os pacientes aprovados e não aprovados, o diâmetro do nervo coclear ipsilateral e a área de seção transversal (tabela 5) (p=0,93 e 0,26, respectivamente).
Falhas e sucessos no teste MTP e diâmetro do nervo coclear ipsilateral e área transversal aos 6 e 12 meses. Valores em negrito são dados significativos
| Nervo Coclear(ipsilateral) | Falha no 6° mês | Sucesso no 6° mês | p | ||
|---|---|---|---|---|---|
| Média±DP | Mediana (Mín‐máx) | Média±DP | Mediana (Mín‐máx) | ||
| Diâmetro | 680,6±108,3 | 667 (539,2−904,3) | 720,8±106,4 | 731 (505−867) | 0,320 |
| Área | 0,014±0,002 | 0,015 (0,012−0,016) | 0,015±0,001 | 0,016 (0,015−0,018) | 0,012 |
| Falha no 12° mês | Sucesso no 12° mês | p | |||
|---|---|---|---|---|---|
| Média±DP | Mediana (Mín‐máx) | Média±DP | Mediana (Mín−Máx) | ||
| Diâmetro | 702,0±61,6 | 718 (601−764) | 699,1±114,2 | 693 (504−904) | 0,93 |
| Área | 0,014±0,001 | 0,015 (0,012−0,016) | 0,015±0,001 | 0,015 (0,012−0,018) | 0,260 |
Teste U de Mann‐Whitney.
O implante coclear é um método de tratamento eficaz para a reabilitação da perda auditiva neurossensorial profunda. Entretanto, os resultados do implante coclear são altamente variáveis e dependem principalmente de fatores médico‐cirúrgicos individuais, bem como das perspectivas fonoaudiológicas.3 Entre esses fatores, fatores anatômicos, como malformações do ouvido interno, têm grande impacto no sucesso do implante coclear. É bem conhecido o fato de que a hipoplasia ou aplasia do nervo coclear tem resultados variáveis após o implante e a detecção pré‐operatória dessas situações é importante.27,28 Embora não seja hipoplásico ou aplástico, o tamanho do nervo coclear pode afetar o processo de reabilitação pós‐operatória. Por esse motivo, conduzimos esta investigação para determinar o efeito de pequenas diferenças no tamanho do nervo coclear no sucesso do implante coclear no período pós‐operatório.
Antes da cirurgia de implante coclear, é necessária uma avaliação abrangente dos pacientes para prever os resultados. Para avaliação das estruturas da orelha interna, é obrigatória a tomografia computadorizada e a RM do osso temporal. As imagens da tomografia computadorizada fornecem informações muito detalhadas sobre as estruturas ósseas da orelha interna, mas sua capacidade de identificar nervos dentro do conduto auditivo interno é limitada,29 enquanto a ressonância magnética pode ser muito útil para visualizar nervos e estruturas cerebrais em candidatos a implante coclear. Pacientes com diâmetro normal do condutoauditivo interno em imagens de TC podem ter nervos cocleares ausentes na RM e os médicos não devem confiar apenas nos achados da TC sobre a morfologia da orelha interna.29 Por esses motivos, a morfologia do nervo coclear deve ser analisada na RM por medidas milimétricas ou que comparem o seu tamanho com o tamanho do nervo facial.30
Há vários estudos que usaram avaliação radiológica do tamanho do nervo coclear em vários grupos de pacientes e em indivíduos com audição normal. Lou et al. investigaram o tamanho do nervo coclear em 3 pontos de mensuração por RM 3‐T e analisaram o efeito da idade no tamanho do nervo coclear em crianças ouvintes normais. Eles verificaram que o maior valor do nervo estava no ponto médio da CAI e o tamanho não mudou com a idade.31 Herman et al. mediram a área da seção transversal do nervo coclear em pacientes com audição normal e surdos pós‐linguais por RM e concluíram que a ressonância magnética parassagital com sequência CISS era uma técnica confiável para medir o nervo coclear. Eles verificaram que a AST dos pacientes surdos era significantemente menor do que a dos indivíduos ouvintes normais.32 Russo et al. usaram RM de alta resolução para avaliar o tamanho do nervo coclear em crianças com perda auditiva neurossensorial e audição normal e descobriram que os nervos cocleares eram levemente hipoplásicos em pacientes com perda auditiva profunda. Eles concluíram que medidas precisas do nervo coclear podem ser feitas com RM de alta resolução.18 Stjernholm e Muren, para determinar os diâmetros do nervo coclear e o tamanho do nervo, usaram a TC dos ossos temporais e mediram o canal do nervo radiologicamente para comparar com as medidas feitas nos modelos dos mesmos ossos temporais. Eles observaram que as medidas nos modelos eram maiores do que as medidas na TC. Eles concluíram que as medidas nas imagens da TC podem não passar exatamente pelo ponto médio do nervo e podem não refletir as medidas reais.33
Também usamos RM de alta resolução para avaliar o tamanho do nervo coclear. Incluímos pacientes com nervos cocleares de aparência e tamanho normais quando os critérios sugeriam que os nervos cocleares são ligeiramente maiores do que os nervos faciais e isso pode ser usado na determinação de anormalidades do nervo coclear propostas por Miyasaka.30 Em estudos anteriores foi demonstrado que o nervo facial pode ser uma referência para avaliação do nervo coclear em pacientes com perda auditiva.34
Neste estudo, as imagens reformatadas parassagitais foram usadas para visualizar o nervo coclear e as medidas foram feitas nessas imagens. Como as medidas do diâmetro podem não refletir o tamanho real do nervo, pois os nervos cocleares podem não ser circulares e o ponto de medição pode não passar do ponto médio, também calculamos a AST. Nossos achados não revelaram diferença entre o lado implantado e o contralateral. Além disso, não houve diferença no diâmetro do nervo e a AST entre sexo e idade. Na população pediátrica, à medida que o desenvolvimento e o crescimento continuam, aumenta a preocupação com a alteração do tamanho do nervo coclear com a idade. No entanto, com base em estudos embriológicos, o nervo vestibulococlear mostrou‐se totalmente desenvolvido na 6ª semana de vida embrionária e não mudou com o desenvolvimento físico.35 Além disso, existem vários trabalhos que investigaram o tamanho do nervo coclear em diferentes faixas etárias, de recém‐nascidos a indivíduos idosos. Russo et al., em seu estudo com crianças com audição normal, não encontraram diferença no diâmetro do nervo coclear em diferentes faixas etárias.18 Lou et al. não demonstraram diferença significante nos diâmetros dos NCs das crianças com o aumento da idade através de um agrupamento mais detalhado, forneceram evidências de imagem.31 Assim, neste estudo, não dividimos os pacientes de acordo com a idade, pois ela não influencia o diâmetro do nervo coclear. Além disso, neste estudo, nossa preocupação não era investigar o efeito da idade no tamanho do nervo, mas estudar se o efeito de pequenas diferenças no tamanho do nervo afeta o resultado auditivo independentemente do fator etário.
Também é lógico considerar se a marca do implante pode afetar os resultados auditivos. Em um estudo feito por Bazon et al., duas estratégias de codificação da fala de diferentes marcas foram comparadas e eles não encontraram diferença significante na percepção da fala.36 Ainda em outro estudo, Jang et al. trabalharam com duas marcas diferentes de implantes cocleares para investigar o desempenho pós‐operatório e verificaram que não havia diferença entre os escores das palavras monossilábicas de grupo aberto, palavras dissilábicas de grupo aberto e sentenças de grupo aberto.37 Portanto, neste estudo, não discriminamos entre as marcas de implantes e acreditamos que o desempenho pós‐operatório de cada marca seja semelhante.
A ferramenta de avaliação EARS® avalia o desenvolvimento da percepção auditiva após o implante coclear, fornece informações para o ajuste do dispositivo e fornece um instrumento para a avaliação em longo prazo de crianças com implantes cocleares.38 A ferramenta EARS® foi usada em muitos estudos anteriores para avaliar o desenvolvimento da percepção auditiva no mesmo grupo de pacientes.39 A ferramenta também foi usada para comparar pacientes em diferentes faixas etárias40 ou pacientes com a mesma idade, mas diferentes grupos com vários fatores etiológicos para perda auditiva.41 Embora diferentes faixas etárias e diferentes fatores etiológicos da perda auditiva mostrem diferentes gráficos de melhoria, em geral após o implante e a reabilitação, a percepção auditiva melhora ao longo do tempo e essa melhora ocorre regularmente em intervalos de 6 meses ou um ano.38 Os estudos também demonstraram que, quanto mais cedo o implante é feito, melhores são as respostas auditivas.39 Neste estudo, avaliamos nossos pacientes com a ferramenta de avaliação EARS®. A avaliação foi feita no 1° mês, no 6° e no 12° mês, com diferentes ferramentas, e detectamos que as respostas ao teste MTP aumentaram constantemente ao longo do tempo e os pacientes com escores altos no MTP no 1° mês demonstraram escores altos nos testes seguintes. Além disso, os pacientes implantados com pouca idade tiveram escores altos em todos os testes, embora os resultados não tenham sido estatisticamente significativos.
Embora existam muitos relatos radiológicos sobre o tamanho do nervo coclear, o conhecimento sobre o efeito do tamanho do nervo coclear no sucesso do implante em crianças surdas pré‐linguais é limitado. Yamazaki et al. classificaram os pacientes de acordo com a razão entre o nervo facial e o nervo coclear por RM e descobriram que pacientes com nervos cocleares maiores do que os nervos faciais tinham um desempenho melhor após o implante coclear.42 Morita et al. avaliaram a relação entre o resultado do implante coclear e o diâmetro do nervo coclear na RM em 20 crianças surdas pré‐linguais e descobriram que não houve correlação entre os diâmetros máximos dos nervos e idade, valores do potencial de ação composto eletricamente evocado (ECAP) e escores do IT‐MAIS. Eles concluíram que a identificação do nervo coclear na RM era suficiente para esperar melhores efeitos, independentemente dos diâmetros.14 Kim et al. investigaram a correlação do tamanho do nervo coclear e do desempenho auditivo após o implante coclear em pacientes pós‐linguais. Eles avaliaram 68 pacientes e mediram o diâmetro do nervo coclear e AST em imagens de RM. Eles descobriram que a AST era negativamente associada à duração e ao grau de perda auditiva. Eles também detectaram que a AST era positivamente correlacionada com o desempenho auditivo.21 Em nosso estudo, incluímos crianças surdas pré‐linguais e, como apenas a medida do diâmetro pode não refletir o tamanho real do nervo, calculamos o diâmetro do nervo coclear e a AST do nervo. Em nosso grupo, nenhum dos pacientes apresentava nervos cocleares hipoplásicos ou aplásicos (os nervos cocleares eram maiores do que os nervos faciais). Como esperado, e demonstrado por dois estudos anteriores, o diâmetro dos nervos não se correlacionou significativamente com o desempenho audiológico no pós‐operatório. Isso pode ocorrer porque o nervo pode não ter forma circular e as medidas podem não refletir o tamanho real. Entretanto, a área transversal dos nervos cocleares apresentou correlação significativa com a percepção auditiva pós‐operatória. Os pacientes com AST mais alta obtiveram melhores escores nos testes MTP nas avaliações do 1°, 6° e 12° mês. Nadol e Xu mediram os nervos cocleares em cadáveres e descobriram que os cadáveres com nervos pequenos tinham menos células ganglionares espirais residuais.43 A área de seção transversal pode se correlacionar com células ganglionares espirais residuais, o que melhora os resultados do implante coclear.32 Acreditamos que a AST do nervo coclear fornece melhores informações sobre a morfologia do nervo, uma vez que sua forma irregular pode superestimar o diâmetro. Além disso, a AST pode refletir a densidade das células ganglionares espirais, o que explica os melhores resultados. Acreditamos que, embora normal em aparência, pequenas diferenças na AST do nervo coclear podem afetar o desempenho e a medida do tamanho do nervo coclear nas imagens de RM parassagital pode fornecer informações úteis sobre o processo de reabilitação pós‐operatória.
ConclusãoEntre os muitos fatores que influenciam os resultados do implante coclear, a presença do nervo coclear pode ser o fator mais importante, embora pequenas alterações consideradas normais no tamanho no diâmetro do nervo possam produzir resultados auditivos diferentes. A medida da AST do nervo coclear de aparência normal pode fornecer dados prognósticos importantes sobre os resultados do implante coclear. Nosso estudo demonstrou que em pacientes com AST maior, o desempenho auditivo foi melhor e mais rápido.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Gozen ED, Yener HM, Kara H, Atas A, Kizilkilic O, Cansiz H. Does size of the cochlear nerve effect postoperative auditory performance in pediatric cochlear implant patients with normal cochlear nerves? Braz J Otorhinolaryngol. 2022;88:390–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.