Picnodisostose é uma síndrome autossômica recessiva rara que resulta em um metabolismo ósseo anormal e aumenta a suscetibilidade dos pacientes a desenvolver osteomielite.
ObjetivoAnalisar os fatores de risco associados ao desenvolvimento de complicações nos maxilares (fraturas e osteomielite), assim como suas características anatomoclínicas e abordagens terapêuticas nos pacientes com picnodisostose.
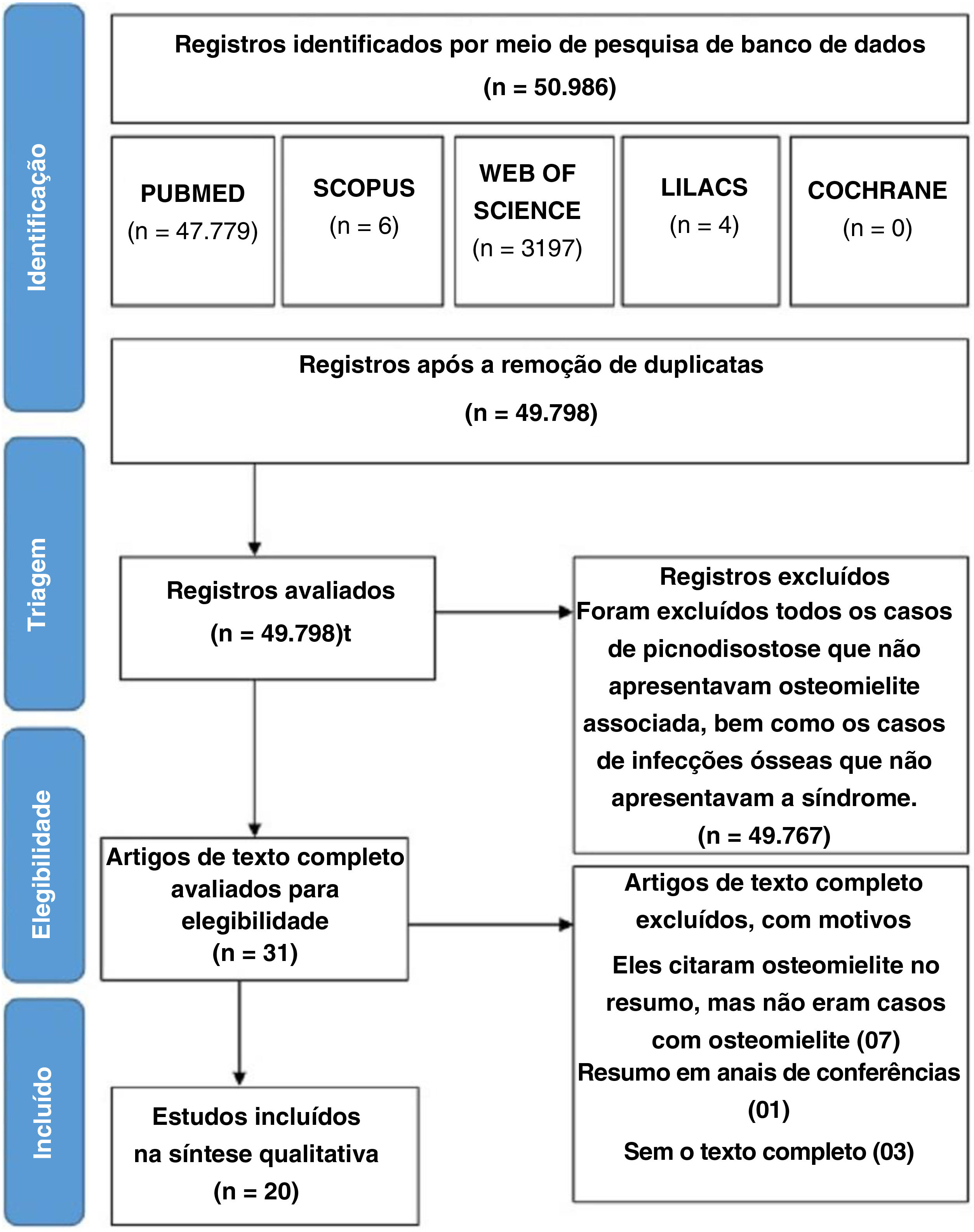
MétodoAs buscas foram feitas nas bases de dados PubMed, Web of Science, Scopus, Lilacs e Cochrane. Foram incluídos relatos de casos ou séries de casos que atenderam aos critérios de elegibilidade de acordo com o PRISMA. Os textos completos de 31 artigos foram analisados. Foram selecionados 20 desses artigos, publicados entre 1969 e 2018, e que descreveram 26 casos de osteomielite em pacientes com picnodisostose.
ResultadosA média de idade dos pacientes foi de 37,84 anos; a proporção do sexo masculino para o feminino foi de 1,36:1. A mandíbula foi o local mais afetado (76,9%). A extração dentária foi o principal fator de risco para osteomielite (61,5%), seguida de infecção (26,8%) e fratura mandibular (23,0%). A antibioticoterapia isolada ou associada a algum procedimento cirúrgico foi o tratamento usado na maioria dos casos (80,7%).
ConclusãoOs achados desta revisão mostraram que os pacientes com picnodisostose têm maior probabilidade de desenvolver osteomielite dos maxilares após procedimentos cirúrgicos, principalmente na extração dentária, e configura o principal fator de risco para o seu estabelecimento. Além disso, a antibioticoterapia profilática pré e pós‐operatória pode prevenir o desenvolvimento de osteomielite em pacientes com picnodisostose.
A picnodisostose (PYCD) é uma síndrome autossômica recessiva rara que pertence ao grupo das displasias ósseas. Esse distúrbio é causado por mutações no gene CTSK localizado no cromossomo 1q211,2 que codifica a catepsina K, uma cisteína protease lisossômica presente nos osteoclastos e que participa da degradação do colágeno tipo I (proteína predominante na matriz óssea). Mutações nesse gene causam metabolismo ósseo defeituoso, mais especificamente reabsorção óssea deficiente.2–4
A prevalência de PYCD é de 1 em 1,7 milhão e nenhuma preferência por sexo foi relatada.1 A herança autossômica recessiva é o padrão de transmissão de mutações no gene CTSK, que codifica a catepsina K. Assim, a consanguinidade dos pais é um fator etiológico importante.3–5 A PYCD é caracterizada por metabolismo ósseo anormal, elasticidade óssea reduzida, disfunção endócrina e imunológica e remodelação alterada da matriz extracelular em órgãos como pulmão, tireoide e pele.1,3,5
Pacientes com PYCD comumente exibem um fenótipo de baixa estatura, suturas ósseas abertas, falanges curtas, displasia óssea com densidade alterada da matriz óssea e fraturas patológicas como resultado de elasticidade reduzida e má consolidação óssea. As manifestações orais incluem um ângulo mandibular obtuso, má oclusão, palato ogival e anomalias dentárias.1,6 O metabolismo ósseo anormal aumenta a suscetibilidade dos pacientes a desenvolver osteomielite. Nos ossos gnáticos, os fatores locais relacionados ao desenvolvimento de osteomielite incluem as características ósseas da maxila e da mandíbula, traumas contínuos, procedimentos cirúrgicos alveolares e condições que afetam os dentes, como doença periapical e periodontal.7–9 Deve‐se enfatizar que o tratamento da osteomielite nos ossos gnáticos é difícil e pode exigir grandes ressecções cirúrgicas.5
Portanto, a hipótese deste estudo é que a manipulação dos maxilares em pacientes com PYCD pode favorecer o desenvolvimento de osteomielite. Esta revisão sistemática foi feita para analisar os fatores de risco associados ao desenvolvimento de complicações nos maxilares (fraturas e osteomielite), bem como suas características clinicopatológicas e abordagens terapêuticas em pacientes com PYCD.
MétodoUma revisão sistemática da literatura sobre PYCD com base na declaração PRISMA (preferred reporting items for systematic reviews and meta‐analyses)10 foi feita em 6 de março de 2019 para responder à seguinte questão de pesquisa de acordo com o critério PICO (população, intervenção, controle, e desfecho): “A manipulação cirúrgica dos ossos maxilares é o principal fator de risco para osteomielite em pacientes com PYCD?” Esta revisão sistemática da literatura foi registrada no PROSPERO (Registro prospectivo internacional de revisões sistemáticas) sob o número de protocolo: CRD42020209580.
As bases de dados selecionadas para a revisão sistemática foram PubMed, Web of Science, Scopus, Cochrane e Lilacs. Os seguintes termos de pesquisa foram usados: “pycnodysostosis” OR “pyknodysostosis” AND “surgery, oral” OR “maxillofacial surgery” OR “oral surgery” OR “exodontics” OR “dentistry, operative” OR “surgical procedures, oral” OR “procedure, oral surgical” OR “procedures, oral surgical” OR “surgical procedure, oral” OR “maxillofacial procedures” OR “maxillofacial procedure” OR “procedure, maxillofacial” OR “procedures, maxillofacial” OR “tooth extraction” AND “osteomyelitis” OR “osteomyelitides” OR “diseases, infectious bone” OR “bone diseases, infectious” OR “diseases, infectious bone” OR “infectious bone disease” OR “infectious bone diseases” (tabela suplementar 1).
Os critérios de inclusão foram estudos publicados que investigaram especificamente osteomielite dos maxilares em pacientes com PYCD. Apenas relatos de casos e séries de casos foram incluídos. Foram excluídos estudos que não abordaram a osteomielite como uma complicação nos maxilares, estudos que abordaram a osteomielite em outros ossos que não os maxilares, artigos que não relataram a causa primária da osteomielite, estudos baseados em modelos animais, estudos in vitro, cartas editoriais, artigos de revisão e estudos cujo texto completo não estava disponível através de empréstimo entre as bibliotecas. Os artigos foram selecionados de forma independente por dois dos autores. Primeiramente, os autores selecionaram os artigos através da leitura do título e resumo, de acordo com os critérios de inclusão e exclusão estabelecidos. Os artigos não relacionados ao tema foram excluídos. O texto completo dos demais estudos foi baixado e os artigos foram selecionados com base nos critérios de elegibilidade. Os artigos cujo texto completo não estava disponível foram excluídos e foi determinada a amostra final dos estudos para síntese qualitativa. As discrepâncias foram resolvidas por um terceiro autor.
Os estudos elegíveis foram revisados e os seguintes dados foram extraídos: (1) autores e ano de publicação; (2) número de pacientes; (3) sexo e idade (média) do paciente; (4) causa; (5) características clínicas (história familiar, localização, sintomas) e radiográficas; (6) intervenção terapêutica e desfecho, (7) e seguimento do paciente. Os revisores não apresentaram divergências na seleção dos artigos. A qualidade metodológica dos artigos foi avaliada de acordo com as diretrizes CARE para relatos de caso, uma lista de verificação qualitativa para estudos observacionais e relatos de caso.
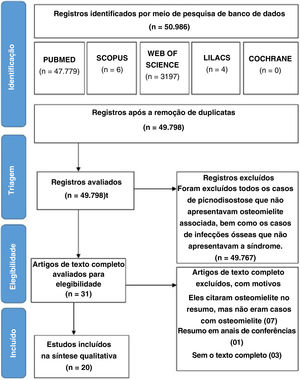
ResultadosResultados geraisA busca na base de dados eletrônica foi atualizada pela última vez em março de 2019 e resultou em 50.986 registros: 47.779 no PubMed, 3.197 na Web of Science, 4 na Lilacs, 6 na Scopus e 0 na Biblioteca Cochrane. Após a retirada das duplicatas, foram obtidos 49.798 registros, que foram selecionados de acordo com os critérios de inclusão e exclusão. Nessa fase, 31 artigos foram considerados relevantes para o tópico (os outros 49.767 estudos não abordaram especificamente o PYCD). Os textos completos desses 31 artigos foram avaliados quanto à elegibilidade, levaram à inclusão de 20 estudos. O fluxograma do processo de seleção dos estudos adaptado da declaração PRISMA é apresentado na figura 1. Por fim, 20 artigos publicados entre 1969 e 2018 foram recuperados pelos autores, corresponderam a 26 casos de osteomielite em PYCD. Foram analisados os dados etiológicos, clínicos, histológicos, biológicos e terapêuticos de cada um dos 26 pacientes incluídos no estudo. Devido à heterogeneidade da literatura disponível e à falta de dados em vários estudos, os autores decidiram limitar‐se a uma análise estatística descritiva e não a fazer uma metanálise.
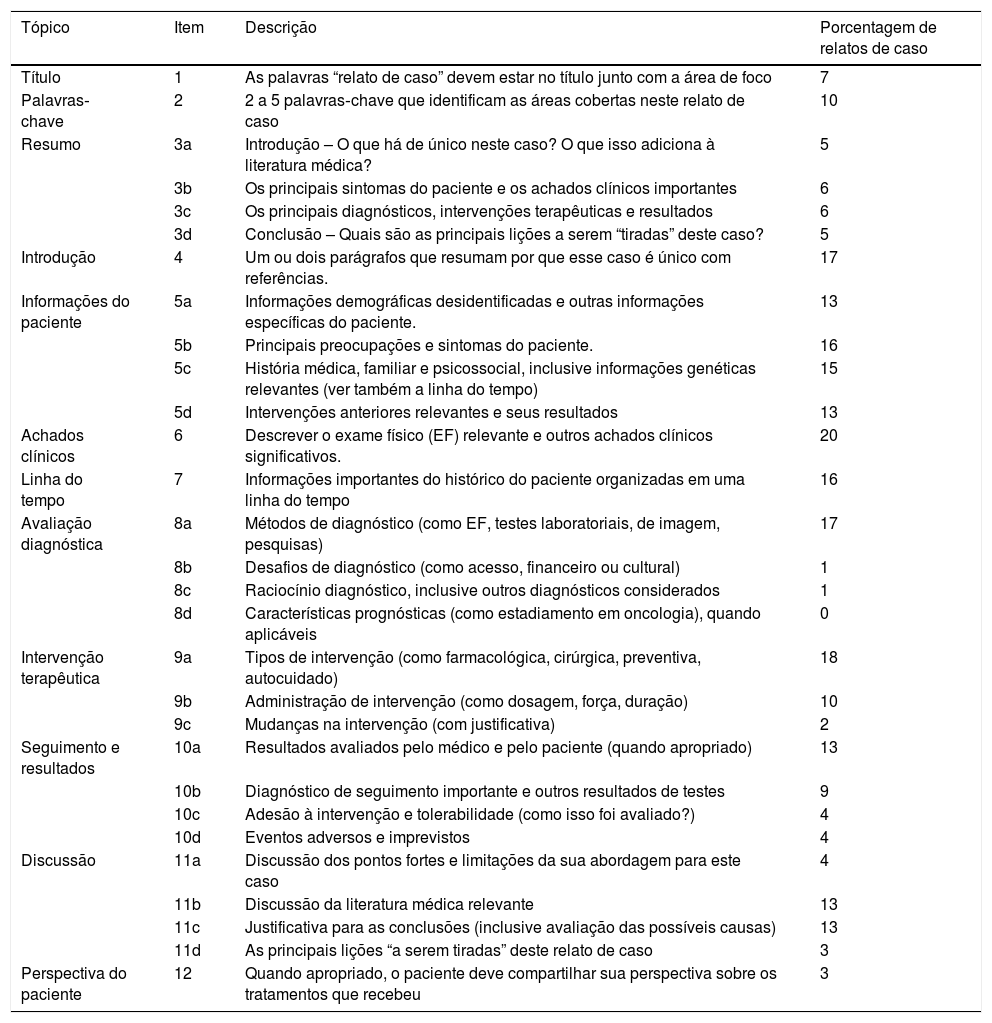
Avaliação de qualidadeA qualidade dos artigos foi estabelecida com as diretrizes CARE para relatos de caso (2013) e os resultados são mostrados na tabela 1. Dos 29 itens da lista de verificação CARE (2013), o estudo de Kirita et al.11 aderiu ao maior número de itens (20 itens), seguido pelos estudos de Kamat et al.,2 Fénelon et al.12 (18 itens), Kato et al.13 e Frota et al.14 (17 itens). Em contraste, os relatos de caso de Emami‐Ahari et al.15 e Dimitrakopoulos et al.16 aderiram a apenas alguns itens (6 e 8 itens, respectivamente). O tópico de achados clínicos foi o item mais relatado, foi descrito em todos os artigos (n=20). Por outro lado, o item prognóstico não foi abordado. O item “raciocínio diagnóstico incluindo outros diagnósticos considerados” foi relatado apenas no estudo de Dhameliya et al.17
Avaliação de qualidade para a lista de verificação CARE
| Tópico | Item | Descrição | Porcentagem de relatos de caso |
|---|---|---|---|
| Título | 1 | As palavras “relato de caso” devem estar no título junto com a área de foco | 7 |
| Palavras‐chave | 2 | 2 a 5 palavras‐chave que identificam as áreas cobertas neste relato de caso | 10 |
| Resumo | 3a | Introdução – O que há de único neste caso? O que isso adiciona à literatura médica? | 5 |
| 3b | Os principais sintomas do paciente e os achados clínicos importantes | 6 | |
| 3c | Os principais diagnósticos, intervenções terapêuticas e resultados | 6 | |
| 3d | Conclusão – Quais são as principais lições a serem “tiradas” deste caso? | 5 | |
| Introdução | 4 | Um ou dois parágrafos que resumam por que esse caso é único com referências. | 17 |
| Informações do paciente | 5a | Informações demográficas desidentificadas e outras informações específicas do paciente. | 13 |
| 5b | Principais preocupações e sintomas do paciente. | 16 | |
| 5c | História médica, familiar e psicossocial, inclusive informações genéticas relevantes (ver também a linha do tempo) | 15 | |
| 5d | Intervenções anteriores relevantes e seus resultados | 13 | |
| Achados clínicos | 6 | Descrever o exame físico (EF) relevante e outros achados clínicos significativos. | 20 |
| Linha do tempo | 7 | Informações importantes do histórico do paciente organizadas em uma linha do tempo | 16 |
| Avaliação diagnóstica | 8a | Métodos de diagnóstico (como EF, testes laboratoriais, de imagem, pesquisas) | 17 |
| 8b | Desafios de diagnóstico (como acesso, financeiro ou cultural) | 1 | |
| 8c | Raciocínio diagnóstico, inclusive outros diagnósticos considerados | 1 | |
| 8d | Características prognósticas (como estadiamento em oncologia), quando aplicáveis | 0 | |
| Intervenção terapêutica | 9a | Tipos de intervenção (como farmacológica, cirúrgica, preventiva, autocuidado) | 18 |
| 9b | Administração de intervenção (como dosagem, força, duração) | 10 | |
| 9c | Mudanças na intervenção (com justificativa) | 2 | |
| Seguimento e resultados | 10a | Resultados avaliados pelo médico e pelo paciente (quando apropriado) | 13 |
| 10b | Diagnóstico de seguimento importante e outros resultados de testes | 9 | |
| 10c | Adesão à intervenção e tolerabilidade (como isso foi avaliado?) | 4 | |
| 10d | Eventos adversos e imprevistos | 4 | |
| Discussão | 11a | Discussão dos pontos fortes e limitações da sua abordagem para este caso | 4 |
| 11b | Discussão da literatura médica relevante | 13 | |
| 11c | Justificativa para as conclusões (inclusive avaliação das possíveis causas) | 13 | |
| 11d | As principais lições “a serem tiradas” deste relato de caso | 3 | |
| Perspectiva do paciente | 12 | Quando apropriado, o paciente deve compartilhar sua perspectiva sobre os tratamentos que recebeu | 3 |
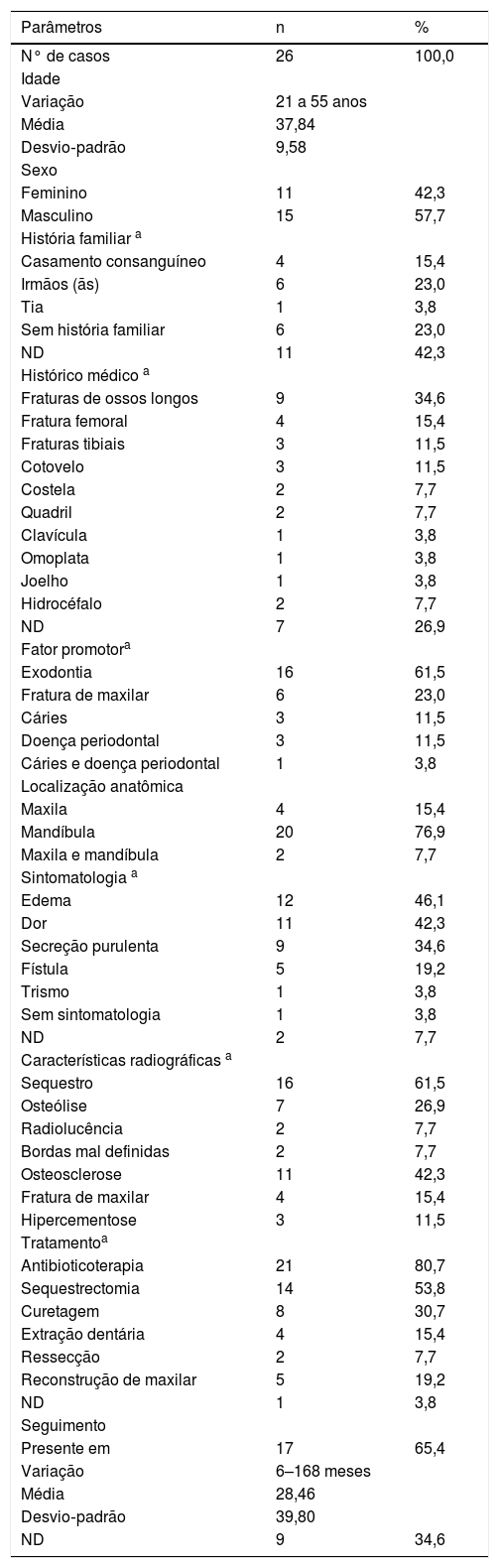
Vinte e seis casos de osteomielite de maxilares relacionada ao PYCD foram descritos nos 20 artigos selecionados. Os homens foram mais comumente afetados (n=15) do que as mulheres (n=11), com uma proporção entre homens e mulheres de 1,36:1. A idade dos pacientes variou de 21 a 55 anos (média de 37,84±9,58 anos), como descrito na tabela 2.
Etiologia, características clínicas e radiográficas dos 27 casos de osteomielite em pacientes com picnodisostose
| Parâmetros | n | % |
|---|---|---|
| N° de casos | 26 | 100,0 |
| Idade | ||
| Variação | 21 a 55 anos | |
| Média | 37,84 | |
| Desvio‐padrão | 9,58 | |
| Sexo | ||
| Feminino | 11 | 42,3 |
| Masculino | 15 | 57,7 |
| História familiar a | ||
| Casamento consanguíneo | 4 | 15,4 |
| Irmãos (ãs) | 6 | 23,0 |
| Tia | 1 | 3,8 |
| Sem história familiar | 6 | 23,0 |
| ND | 11 | 42,3 |
| Histórico médico a | ||
| Fraturas de ossos longos | 9 | 34,6 |
| Fratura femoral | 4 | 15,4 |
| Fraturas tibiais | 3 | 11,5 |
| Cotovelo | 3 | 11,5 |
| Costela | 2 | 7,7 |
| Quadril | 2 | 7,7 |
| Clavícula | 1 | 3,8 |
| Omoplata | 1 | 3,8 |
| Joelho | 1 | 3,8 |
| Hidrocéfalo | 2 | 7,7 |
| ND | 7 | 26,9 |
| Fator promotora | ||
| Exodontia | 16 | 61,5 |
| Fratura de maxilar | 6 | 23,0 |
| Cáries | 3 | 11,5 |
| Doença periodontal | 3 | 11,5 |
| Cáries e doença periodontal | 1 | 3,8 |
| Localização anatômica | ||
| Maxila | 4 | 15,4 |
| Mandíbula | 20 | 76,9 |
| Maxila e mandíbula | 2 | 7,7 |
| Sintomatologia a | ||
| Edema | 12 | 46,1 |
| Dor | 11 | 42,3 |
| Secreção purulenta | 9 | 34,6 |
| Fístula | 5 | 19,2 |
| Trismo | 1 | 3,8 |
| Sem sintomatologia | 1 | 3,8 |
| ND | 2 | 7,7 |
| Características radiográficas a | ||
| Sequestro | 16 | 61,5 |
| Osteólise | 7 | 26,9 |
| Radiolucência | 2 | 7,7 |
| Bordas mal definidas | 2 | 7,7 |
| Osteosclerose | 11 | 42,3 |
| Fratura de maxilar | 4 | 15,4 |
| Hipercementose | 3 | 11,5 |
| Tratamentoa | ||
| Antibioticoterapia | 21 | 80,7 |
| Sequestrectomia | 14 | 53,8 |
| Curetagem | 8 | 30,7 |
| Extração dentária | 4 | 15,4 |
| Ressecção | 2 | 7,7 |
| Reconstrução de maxilar | 5 | 19,2 |
| ND | 1 | 3,8 |
| Seguimento | ||
| Presente em | 17 | 65,4 |
| Variação | 6–168 meses | |
| Média | 28,46 | |
| Desvio‐padrão | 39,80 | |
| ND | 9 | 34,6 |
A história familiar de PYCD não foi relatada em oito artigos, correspondeu a 11 casos sem informação. A maioria dos artigos em que essa informação estava disponível relatou consanguinidade ou história familiar da doença: irmãos (n=6), filhos de pais consanguíneos, principalmente primos (n=4) e tia paterna (n=1). Seis pacientes não tinham história familiar da doença.
A história clínica revelou história de algum tipo de fratura óssea, principalmente nos ossos longos (n=9). As fraturas ósseas envolveram fêmur (n=4), tíbia (n=3), cotovelos (n=3), costelas (n=2), quadril (n=2), clavícula (n=1), escápula (n=1) e joelho (n=1). Dois casos tinham história de hidrocefalia.
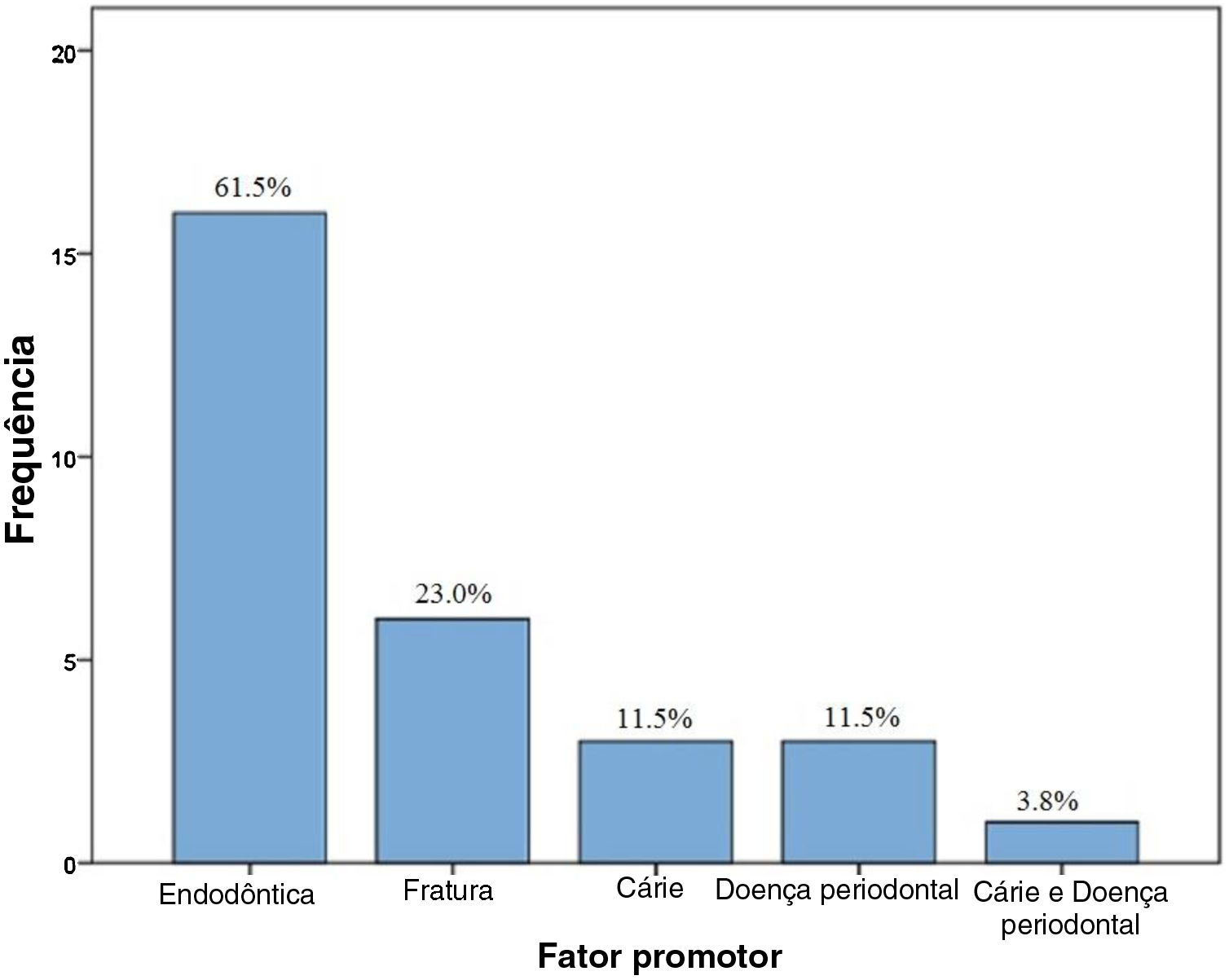
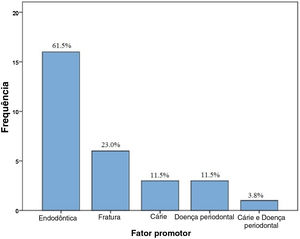
Entre os 26 casos de osteomielite relacionada a PYCD encontrados na literatura, a exodontia foi o principal fator de risco em 16 casos (61,5%), seguido por história de fratura de maxilar (n=6,23,0%) e presença de infecção, como cárie (n=3, 11,5%) e doenças periodontais (n=3, 11,5%). A presença simultânea de cárie e lesão periodontal foi observada em um caso (3,8%), como mostrado na figura 2. Todos os fatores de risco para o desenvolvimento de osteomielite são demonstrados na figura 3.
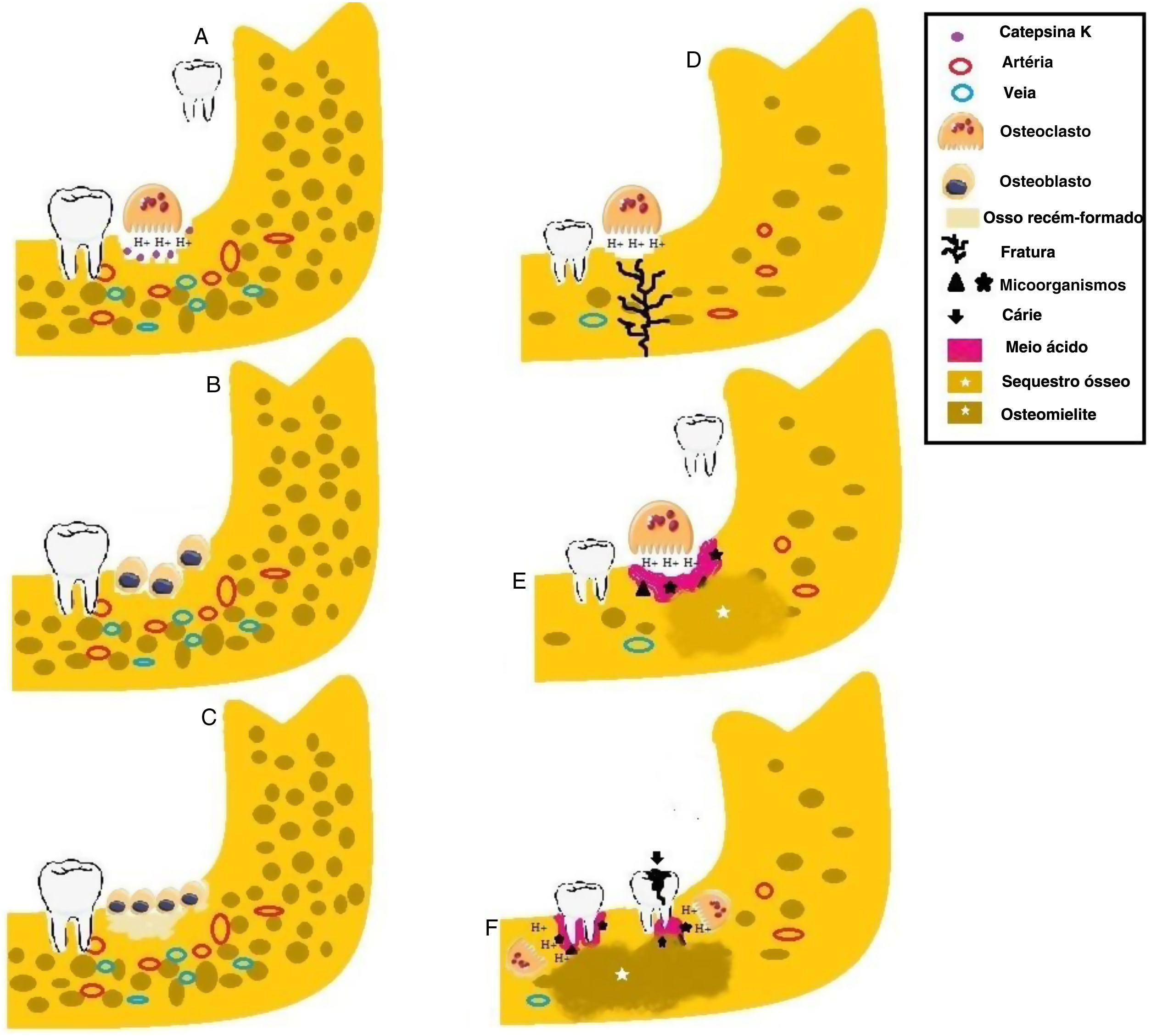
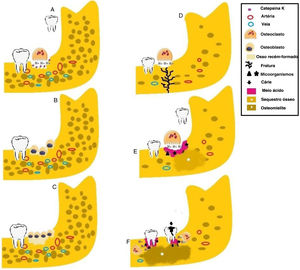
Etiologia da osteomielite em pacientes com picnodisostose. (A) Os osteoclastos liberam H+e Catepsina K nas lacunas de Howship (baías de reabsorção) durante a extração dentária em pacientes com densidade óssea normal. (B) Após a reabsorção óssea, os osteoblastos são atraídos para o local e iniciam o processo de neoformação óssea. (C) Osso recém‐formado. (D) Na ausência da Catepsina K, os osteoclastos atuam de forma ineficiente, levam ao meio ácido. Pacientes com osteosclerose são mais suscetíveis a fraturas em resposta a pequenos traumas devido à redução da vascularização óssea. (E) A presença de microrganismos, o meio ácido e o comprometimento do turnover ósseo causam a formação de sequestro ósseo. (F) A cárie e a doença periodontal induzem a liberação de mediadores inflamatórios e produtos microbianos e, associadas à diminuição da atividade osteoclástica, promovem a osteomielite em pacientes com picnodisostose.
Em relação à localização anatômica, houve leve predomínio de osteomielite na mandíbula (n=20, 76,9%) sobre a maxila (n=4, 15,4%). Ambas os maxilares foram afetados em dois casos (7,7%). Os sintomas mais comuns foram inchaço e edema (n=12), seguidos por dor (n=11), secreção purulenta (n=9), presença de fístula (n=5) e trismo (n=1). A informação sobre os sintomas não estava disponível em dois casos.
Como características radiográficas, a osteomielite foi acompanhada por sequestro ósseo (n=16), osteólise (n=7), radiolucência (n=2) e bordas mal definidas (n=2). O aumento da densidade óssea (osteosclerose) foi observado em 11 dos casos e foi o padrão mais comum após o sequestro ósseo. Em quatro casos, a fratura dos maxilares foi demonstrada através de radiografia. Hipercementose que envolveu os dentes permanentes foi observada em três casos.
Intervenções terapêuticas e seguimentoO tratamento da osteomielite variou de conservador (antibioticoterapia e curetagem) a abordagens mais radicais (extração dentária, sequestrectomia e ressecção). A antibioticoterapia foi o tratamento de escolha em 21 casos, seguida de sequestrectomia (n=14), curetagem (n=8), exodontia (n=4) e ressecção (n=2).
Dos 21 casos que receberam antibioticoterapia, 13 deles especificaram o antibiótico usado, embora apenas oito relatassem a posologia e o tempo de uso (tabela suplementar 2). Cultura e antibiograma foram feitos em 3 artigos, determinaram carbenicilina e ampicilina,18 clindamicina,14 moxifloxacina (400mg uma vez ao dia), injeção de Cefotaxima sódica (1g duas vezes ao dia) e metronidazol injetável (500mg três vezes ao dia).2 Dentro do grupo de penicilinas, o uso de penicilina G com uma concentração média de 11,2 UI foi feito em quatro dos casos.16,19,20 Ampicilina em um esquema de 500mg, 3x/dia por 5 dias, foi usada em um caso;20 em outro caso,18 os autores também usaram ampicilina, mas não especificaram o esquema adotado. O uso de amoxicilina 1g, 2x/dia por 15 dias, foi adotado em dois casos.12 Além disso, flucloxacilina e ticarcilina‐clavulanato foram usados em um caso cada, embora o esquema não tenha sido especificado.21,22 Na classe das lincosamidas, clindamicina 300mg foi o medicamento de escolha, com um esquema 4x/dia por 14 dias em um caso,6 embora nos outros dois artigos o esquema não tenha sido especificado;14,22 além da lincomicina 500mg por 10 dias, usada em um caso.23
Em cinco casos, o tratamento de escolha foi acompanhado de reconstrução dos maxilares. Em alguns casos, a antibioticoterapia profilática foi administrada em combinação com curetagem, extração, sequestrectomia e ressecção.14 O tempo de seguimento foi relatado em 17 casos e variou de 6 a 168 meses, com média de 28,46±39,8 meses.
DiscussãoOs osteoclastos de pacientes com PYCD são incapazes de degradar o colágeno I e outras proteínas não colagenosas que formam a matriz óssea, enquanto essas células mantêm sua atividade desmineralizante, resultam em metabolismo ósseo anormal.24,25 A ausência de catepsina K também parece estimular a formação de osso cortical através do controle negativo da periostina secretada pelos osteoblastos e osteócitos, fato que explica o aparente efeito contraditório do aumento da densidade óssea na PYCD,26,27 demonstrado pela presença de osteosclerose. O último foi observado em 11/26 pacientes.12,14,15,17,20–23,27–29
A qualidade óssea de pacientes com PYCD é baixa (matriz frágil e mal organizada). A resistência óssea é reduzida devido à acidificação, aumenta o risco de fraturas, principalmente nas extremidades inferiores1,27 (fig. 3D). O presente estudo demonstrou fraturas nos ossos longos de 9/26 pacientes, corroborou os achados de aumento da sensibilidade mecânica e aumento do risco de fratura em pacientes com PYCD. Isso pode ser explicado pelo fato de que a Catepsina K é importante para a reabsorção óssea em ossos com uma alta taxa de turnover (por exemplo, ossos longos). O presente estudo demonstrou lesões osteolíticas em 7/26 pacientes.11,13,14,16,19,22
A manifestação da osteomielite depende dos fatores de virulência dos microrganismos, do sistema imunológico e de fatores vasculares do paciente. O aumento da suscetibilidade à osteomielite da mandíbula é atribuído ao aumento da densidade óssea (osteosclerose) que favorece o estabelecimento de osteomielite, que tem menos espaços medulares e um único feixe neurovascular.17 Nossos resultados foram consistentes com a literatura, a mandíbula foi o local mais afetado (n=22).2,5,6,11–15,17–23,27–30
Nos ossos maxilares, a osteomielite é comumente causada pela disseminação de uma infecção odontogênica (n=7)5,11,12,16,17,29 ou por traumas cirúrgicos (n=16).2,5,6,13–15,18–23,27,28,30 Como a cavidade oral abriga microrganismos comensais, doenças e a manipulação dos dentes podem criar uma rota para que os microrganismos entrem no osso.8,31 Uma vez que tenham atingido o osso, a resposta inflamatória pode culminar na produção de pus, aumenta a pressão intramedular e reduz o fluxo sanguíneo para os ossos. Um aumento no osso isquêmico e necrótico contribui para o estabelecimento da infecção,8,32 demonstrado pela presença de sequestro ósseo. A presença de pus pode comprometer até mesmo a integridade do osso cortical. O envolvimento de tecidos moles adjacentes é frequentemente observado, o qual é indicado por edema local (12/26)5,11,13,14,16,17,19,20,23,29 e por fístulas intra‐ ou extraorais,8 como encontrado em 5/26 dos casos relatados.14,15,19,23 Secreção purulenta foi um achado em 9/26 casos.2,5,11,15,17,18,21 Dor (11/26)2,6,12,16,19,20,22,28,29 e trismo (1/26),20 características da osteomielite crônica, o tipo mais comum observado no presente estudo, também foram relatados.
Este estudo demonstrou que a exodontia foi o principal fator de risco para osteomielite. Esses procedimentos são conhecidos por quebrar a barreira óssea e criar um portal de entrada para microrganismos que então povoam o componente ósseo. Além disso, a exodontia é um evento traumático que, em conjunto com a matriz óssea defeituosa na PYCD, favorece a ocorrência de fraturas ósseas (fig. 3E). A radiografia revelou fraturas em quatro casos.13,15,17,21
A osteomielite foi relatada em associação com a periodontite em 4/26 casos.11,16,29 A periodontite é uma doença inflamatória oral comum.33 Há evidências que indicam que a inibição da catepsina K resulta na supressão das células do sistema imunológico e na redução da atividade dos osteoclastos, reduz a desnutrição do osso alveolar na periodontite34 (fig. 3F). A periodontite pode ocorrer em pacientes com PYCD e pode ser a principal causa da osteomielite, conforme destacado no presente estudo.
A investigação do papel da catepsina K em doenças periapicais demonstra que esda protease está envolvida na reabsorção óssea e na ativação do sistema imunológico, bem como em eventos durante o estabelecimento da resposta imune relacionada ao reconhecimento de microrganismos por receptores tipo Toll (TLR, Toll‐Like Receptors) em células dendríticas.33 Na PYCD, os pacientes, portanto, carecem de mecanismos relacionados à limitação da infecção (uma resposta imune efetiva), fato que favorece a invasão dos tecidos medulares e o desenvolvimento de osteomielite, que foi relatada em associação a eventos pulpares em 4/26 casos.5,12,16,17
A terapia antimicrobiana e o desbridamento cirúrgico são as principais modalidades de tratamento para a osteomielite.8,35 Apesar dos avanços nos procedimentos cirúrgicos e na quimioterapia, a osteomielite permanece difícil de tratar e não há um protocolo de tratamento universalmente aceito.8 Nos casos desta revisão sistemática, a antibioticoterapia foi o tratamento de escolha em pacientes com osteomielite associada a PYCD. Esse tratamento foi administrado isoladamente em três artigos2,12,27 ou em combinação com algum procedimento cirúrgico em 15 artigos.5,6,11,12,14–16,18–23,29,30 O antibiótico e o regime de tratamento usados foram especificados na maioria dos casos.
A cultura e o antibiograma são mecanismos de suporte laboratorial usados para determinar com segurança o agente causador da infecção e a antibioticoterapia mais eficaz para combatê‐la. Esse procedimento foi feito em três dos casos desta revisão.2,14,18 Na maioria dos artigos, o regime de antibióticos foi combinado com o uso de dois ou mais medicamentos, inclusive diferentes vias de administração (intramuscular, oral, intravenosa e tópica).16,18–21 A penicilina foi o antibiótico de escolha na maioria dos casos, embora em um dos casos relatados o antibiograma tenha determinado a resistência a esse antibiótico.2 Nos casos em que houve cultura, o antibiótico de escolha foi variável, inclusive penicilina (carbenicilina e ampicilina), lincosamidas (clindamicina), fluoroquinolonas (moxifloxacina), cefalosporinas (cefotaxima) e antibióticos nitroimidazoles (metronidazol).2,14,18
Argumenta‐se que os tratamentos radicais devem ser evitados no manejo da osteomielite associada à PYCD devido ao risco de complicações trans e pós‐operatórias. Em quatro casos,2,5,16,17 os pacientes recusaram a abordagem cirúrgica proposta e optaram por tratamentos mais conservadores. Quatro dos pacientes submetidos a tratamento mais invasivo desenvolveram complicações subsequentes.11,18,19,21 A adesão relatada pelo paciente, a acessibilidade e a tolerabilidade do tratamento adotado devem ser consideradas, como feito em quatro artigos.2,6,12,22 A mudança do tratamento adotado em caso de efeitos colaterais inesperados ou recorrência, como relatado em sete artigos,2,11,12,18,19,21,22 também é importante. Finalmente, a literatura relata que a antibioticoterapia pré‐ (profilaxia antibiótica) e pós‐operatória evita complicações pós‐operatórias de procedimentos odontológicos invasivos. Além disso, esses procedimentos favorecem a reparação de tecidos na região cirúrgica, raspagem subgengival e necropulpectomias.36,37
ConclusãoOs achados desta revisão mostraram que os pacientes com PYCD têm maior probabilidade de desenvolver osteomielite dos maxilares, principalmente após a exodontia, e configuram o principal fator de risco para o seu estabelecimento. Sempre que possível, a antibioticoterapia pré‐ (profilaxia antibiótica) e pós‐operatória parece ser adequada em pacientes com PYCD até a cicatrização completa do tecido, mesmo no caso de procedimentos menores, a fim de evitar complicações como osteomielite e fraturas patológicas. Além disso, um tratamento mais conservador para a osteomielite deve ser escolhido para evitar traumas adicionais aos maxilares.
FinanciamentoDepartamento de Odontologia do Programa de Pós‐Graduação em Patologia Oral.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), código de financiamento 001.
Como citar este artigo: de França GM, Felix FA, de Morais EF, Medeiros MR, Andrade AC, Galvão HC. Osteomyelitis of the jaws in patients with pycnodysostosis: a systematic review. Braz J Otorhinolaryngol. 2021;87:620–8.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.