Introdução: Espectro da neuropatia auditiva ainda é uma condição clínica desafiadora.
Objetivo: Apresentar nossa experiência no tratamento de crianças com espectro da neuropatia auditiva em relação aos dados clínicos.
Método: Este estudo retrospectivo incluiu crianças menores de 16 anos de idade que deram entrada no departamento entre 2005 e 2013 (com exceção de encaminhamentos para triagem auditiva neonatal). Foram avaliados os dados obtidos a partir dos exames de audiometria tonal, emissões otoacústicas (EOA), potencial evocado auditivo de tronco encefálico (ABR) e outros fatores de risco.
Resultados: Das 1.952 crianças com perda auditiva neurossensorial (2,04%) detectadas dentre os 9.520 candidatos que deram entrada no departamento (0,42%), espectro da neuropatia auditiva foi reconhecida em 74 orelhas de 40 crianças (B/U: 34/6). Os testes clínicos revelaram que uma perda auditiva superior a 15 dB estava presente em ambas as orelhas em 38 casos. O grau de perda auditiva das crianças era profundo em 48%, grave em 12%, moderado em 28%, leve em 10%, e normal em 5%. ABR estava ausente/anormal em 37/3 orelhas e microfonia coclear foi detectado em todas as crianças. Reflexos acústicos estavam ausentes em todas as orelhas. A reabilitação foi tratada com implante coclear e aparelhos auditivos em 15 e 23 casos, respectivamente. Um sistema FM foi utilizado em dois casos que apresentavam audição normal, mas discriminação deficiente da fala em ambientes ruidosos.
Conclusão: Espectro da neuropatia auditiva é um problema desafiador para os departamentos de audiologia, devido às suas várias características clínicas e dificuldades no tratamento. Em nossos pacientes a perda auditiva profunda foi a mais frequente. O número de casos negligenciados pode ser diminuído com a realização dos exames ABR e EOA em todos os casos encaminhados com suspeita de perda auditiva.
Introduction: ANSD is a challenging problem.
Objective: To present our experience on management of the children with ANSD with respect to clinical data.
Methods: This retrospective study included all children younger than 16 years of age who applied to the department between 2005 and 2013 (with the exception of newborn hearing screening NHS referrals). The data were derived from pure tone, OAEs and ABR tests, and further medical risk factors of the subjects were evaluated.
Results: ANSD was recognized in 74 ears of 40 children (B/U: 34/6) among 1952 children with SNHL (2.04%) detected among 9520 applicants to the department (0.42%). The clinical tests revealed that hearing loss greater than 15 dB was present in both ears of 38 cases. The degree of hearing loss was profound in 48% children, severe in 12% children, moderate in 28% children, mild in 10% children and normal in 5% children. ABRs were absent/abnormal in 37/3 ears and CMs were detected in all. Acoustic reflexes were absent in all ears. Rehabilitation was managed by CI and hearing aids in 15 and 23 cases, respectively. FM system was given to two cases displaying normal hearing but poor speech discrimination in noisy environments.
Conclusion: ANSD is a relatively challenging problem for the audiology departments because of its various clinical features and difficulties in management. Our patients with ANSD most commonly displayed profound hearing loss. The number of overlooked cases may be minimized by performing ABR and OAE in every case referred with the suspicion of hearing loss.
Introdução
A perda auditiva, conhecida como espectro da neuropatia auditiva (ENA), foi descrita pela presença de emissões otoacústicas (EOA), apesar de as respostas estarem ausentes ou gravemente anormais no potencial evocado auditivo de tronco encefálico (ABR).1-3 Foerst et al. estimaram a prevalência de ENA em 0,94% e 8,44% para crianças em situação de risco de deficiência auditiva e crianças com grave deficiência auditiva, respectivamente.4 Anteriormente, Kraus et al. haviam estimado essas taxas em 1,3% e 14%.5
Há relatos de ENA relacionada a vários padrões clínicos e audiológicos. Os limiares tonais (PTAs) variam de normais ou quase normais a perda auditiva grave, caracterizada especialmente por deficiência das habilidades de processamento auditivo em ambientes ruidosos. Esses indivíduos apresentam escores de discriminação da fala (EDF) muito baixos, os quais não estão associados aos níveis dos limiares tonais. Os reflexos acústicos estão ausentes na maioria dos casos.1,2,6
Tem sido relatado que o processo de tratamento é mais problemático em crianças com ENA que naquelas com outros padrões de perda auditiva, particularmente devido aos padrões mais pobres de EDF em relação a limiares tonais melhores.7-10 Além disso, como o local da lesão nos indivíduos clinicamente alocados no grupo ENA ainda é desconhecido e não há um teste para discriminar o local da lesão dos casos apresentados,2 selecionar uma opção de tratamento torna-se mais difícil.7-10 Atualmente, o principal interesse é saber se o implante coclear (IC) é ou não benéfico nos casos apresentados. No entanto, em alguns casos, pode ser até difícil decidir entre as opções de um aparelho auditivo e “esperar e observar ativamente”.7-10 A abordagem aceita em relação às crianças com ENA é, inicialmente, fornecer a amplificação usando aparelhos auditivos; no entanto, muitos pacientes com ENA apresentam pouca audição funcional e compreensão da fala com a amplificação convencional. Em indivíduos que apresentam dificuldade na compreensão da fala e atraso no desenvolvimento da linguagem com aparelhos auditivos, o implante coclear (IC) pode ser oferecido.2,11
O objetivo deste estudo foi apresentar nossa experiência no tratamento de crianças com ENA em relação aos dados clínicos.
Método
Este estudo retrospectivo incluiu crianças menores de 16 anos de idade que deram entrada no departamento de audiologia entre 2005 e 2013 (Comitê de Ética: 446). Inicialmente, os indivíduos foram divididos em dois subgrupos, de acordo com a presença de perda auditiva neurossensorial (PANS) (> 15 dB)11 e, depois, o grupo com PANS foi dividido em indivíduos com ENA e os outros. Assim, a prevalência de ENA nas crianças que compareceram ao departamento de audiologia e a prevalência de ENA naqueles com PASN foram calculadas.
A avaliação audiológica dos pacientes com suspeita de ENA devia incluir os seguintes critérios: presença de microfonia coclear (MC) e ABR normal ou ausente.
Os dados audiométricos dos indivíduos com ENA e habilidades auditivas de detecção-desenvolvimento da linguagem foram avaliados.
Exames audiométricos
Audiometria tonal em 250-6.000 Hz específica para a idade foi realizada em todos os indivíduos usando métodos conversivos, lúdicos ou comportamentais. As avaliações de detecção e reconhecimento da fala incluíram o teste de reconhecimento da fala (TRF) para crianças e limiar de reconhecimento de fala. Timpanometria e avaliação do reflexo acústico também foram realizadas durante os exames. Os limiares de reflexo acústico foram medidos ipsilateral e contralateralmente com estímulos tonais em 500 a 4.000 Hz. As orelhas estimuladas foram consideradas ausentes quando não houve resposta às intensidades do teste até 110 dB NA.
Emissões otoacústicas
Emissões otoacústicas evocadas por cliques foram medidas por meio do sistema ILO-92 OAE. O nível do clique variou com picos de pressão sonora de 80-86 dB. As respostas a até 260 estímulos foram calculadas sobre uma janela de 20 ms e armazenadas em dois buffers separados. A presença de emissões otoacústicas evocadas transientes normais foi determinada por uma amplitude de resposta de, no mínimo, 3 dB e reprodutibilidade da forma da onda em, pelo menos, três bandas de oitava > 75%.
Audiometria de tronco encefálico
Audiometria de tronco encefálico (ABR) foi registrada em uma configuração de eletrodo único, em um canal de estímulo da testa até a orelha ipsilateral, usando um filtro passa-banda entre 100 e 3.000 Hz. Os estímulos com cliques consistiram em uma polaridade de condensação seguida por uma polaridade de rarefação dos cliques apresentadas monoauralmente a taxas de 13,0 por segundo, e em intensidades de 75 dB e, quando necessário, a 95 dB NA. MC foi demonstrado pela alteração da polaridade em ABR. Os pacientes foram submetidos a avaliação em uma sala à prova de som, em um estado de sono natural ou induzido por hidrato de cloral.
Habilidades de percepção auditiva
A avaliação auditiva das habilidades de percepção das crianças com aparelhos auditivos e implantes cocleares foi realizada por meio do teste dos sons de Ling, a escala IT-MAIS (Infant-Toddler Meaningful Auditory Integration Scale), a escala MUSS (Meaningful Use of Speech Scale) e o questionário LittlEARS.
O teste dos sons de Ling avalia habilidades de percepção auditiva e é usado para estimar tanto a detecção quanto a discriminação de sons. Seis cartões com figuras que simbolizam os sons foram usados para avaliar as crianças durante o teste.
A escala IT-MAIS é uma modificação da escala Meaningful Auditory Integration Scale (MAIS). Trata-se de uma entrevista estruturada, programada para avaliar as respostas espontâneas da criança ao som em ambientes naturais. A avaliação tem como base as informações fornecidas pelos pais em resposta a dez perguntas. Essas perguntas avaliam três áreas principais: 1) o comportamento de vocalização; 2) o alerta aos sons; e 3) a derivação do significado do som. Critérios específicos de pontuação foram desenvolvidos para cada uma das dez perguntas.
A escala MUSS é aplicada com o relato dos pais. Ela foi projetada para avaliar o uso da fala pela criança em situações cotidianas, com dez perguntas que avaliam as seguintes áreas: controle vocal, uso da fala sem gesto ou sinal e uso de estratégias de comunicação em situações cotidianas.
O questionário LittlEARS foi projetado para os pais, para avaliar o comportamento auditivo de crianças com deficiência auditiva que receberam IC ou um aparelho auditivo antes do 24.º mês de vida. O questionário registra o desenvolvimento auditivo pré-verbal durante os dois primeiros anos audição em ambiente natural da criança, levando em consideração a recepção, a compreensão, a resposta adequada e a produção vocal-verbal de estímulos (linguísticos) acústicos. O questionário é composto por 35 perguntas variadas relacionadas à idade, para serem respondidas pelos pais, com “sim” ou “não”.
Avaliação do desenvolvimento da linguagem
A avaliação direta das medidas da linguagem receptiva e expressiva incluiu a Escala da Linguagem em Pré-escolares versão 4 (PLS-4).
Análise estatística
O programa estatístico SPSS 16.0 (SPSS Inc., Chicago, IL, EUA) foi usado. O teste de Wilcoxon foi usado para comparar as pontuações de percepção e linguagem auditivas dos pacientes antes e após a amplificação auditiva.
Resultados
Ao todo, 9.520 crianças foram avaliadas no departamento durante o período do estudo, e perda auditiva neurossensorial foi observada em 1.912 delas (20,08%). ENA foi constatada em 74 orelhas de 40 crianças (23 do sexo masculino e 17 do sexo feminino). A prevalência de ENA na população infantil com perda auditiva neurossensorial foi de 1,89%. A média de idade das crianças com ENA, no momento do diagnóstico, foi determinada em 3,05 ± 2,44.
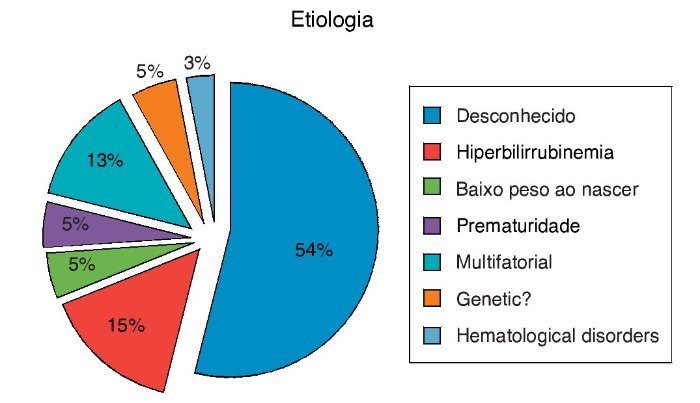
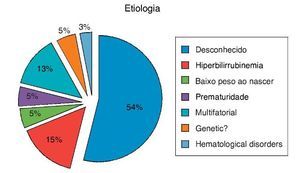
Como mostrado na figura 1, os fatores associados ao ENA foram observados em 19 das 40 crianças; história de hiperbilirrubinemia em 15%, prematuridade em 5%, baixo peso ao nascer em 5%, história genética (irmãos) em 5%, e 54% das crianças não tinham patologia associada ou fator de risco conhecido.
Figura 1. Fatores etiológicos dos pacientes com ENA.
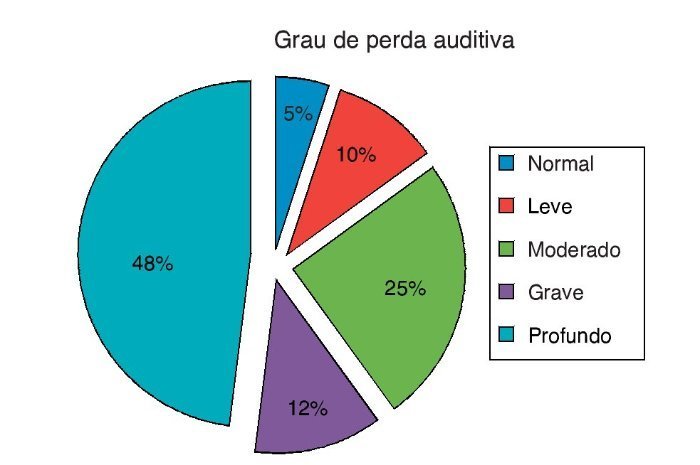
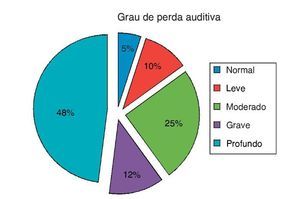
Todas as orelhas dos indivíduos apresentaram timpanograma normal e não apresentaram resposta do reflexo acústico. Como mostrado na figura 2, o grau de perda auditiva era profundo em 48%, grave em 12%, moderado em 28%, leve em 10%, e normal em 5% das crianças.
Figura 2. Grau de perda auditiva dos pacientes com ENA.
EOA transiente e distorção foram detectadas em 32 orelhas, embora o microfonismo coclear (MC) tenha sido observado em todas as orelhas dos pacientes com ENA. Em seis indivíduos com ENA unilateral, as orelhas contralaterais apresentavam perda auditiva grave ou profunda sem MC. Na ABR, enquanto apenas 8% dos pacientes apresentaram alteração da morfologia das ondas, as orelhas restantes não apresentaram ondas-V. A presença MC foi alterada pela lateralização das orelhas com ENA.
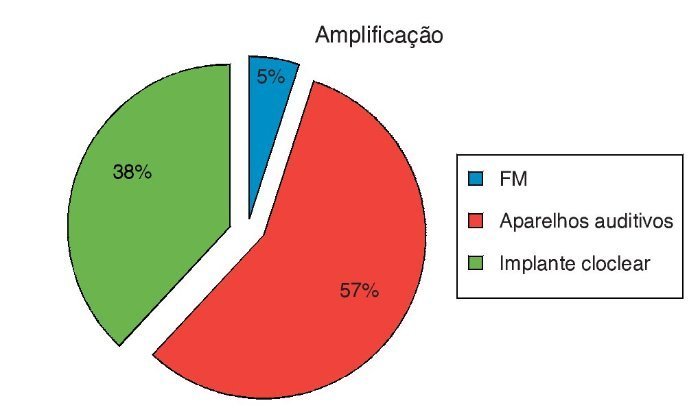
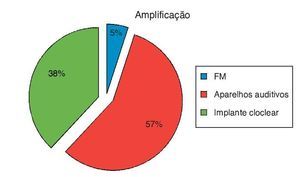
A dois pacientes que apresentaram audição normal foi sugerido o uso do sistema FM para educação. No entanto, os pais dos pacientes não aceitaram. Portanto, não pudemos acompanhar a eficácia do sistema FM em ENA com audição normal (fig. 3).
Figura 3. Opções de amplificação dos pacientes com ENA.
Vinte e três pacientes receberam próteses auditivas. Dois de nossos pacientes com aparelhos auditivos não obtiveram benefício suficiente com o seu uso, mas o implante não foi sugerido devido a idade, uso irregular do aparelho e reabilitação insuficiente. Dos pacientes com aparelhos auditivos, 15 não compareceram para acompanhamento e reabilitação.
Quinze pacientes com ENA receberam indicação para implantes cocleares e foram operados. No período intraoperatório, impedanciometria e telemetria de resposta neural (TRN) se encontravam dentro dos limites normais. Nenhum dos pacientes teve complicações no pós-operatório imediato. Impedanciometria e TRN também estavam dentro dos limites normais no pós-operatório. Porém, quatro dos pacientes não compareceram para acompanhamento e reabilitação.
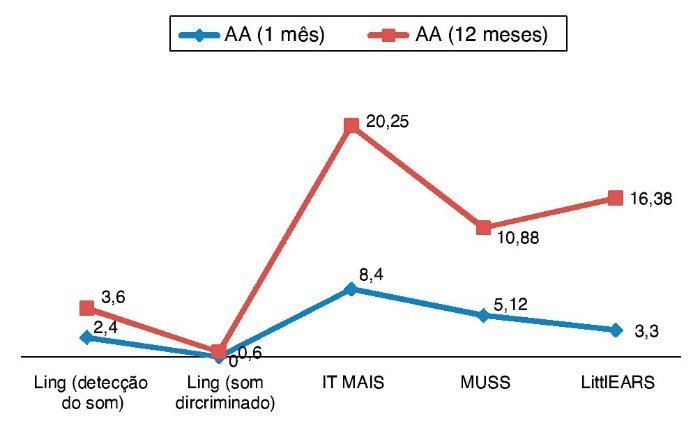
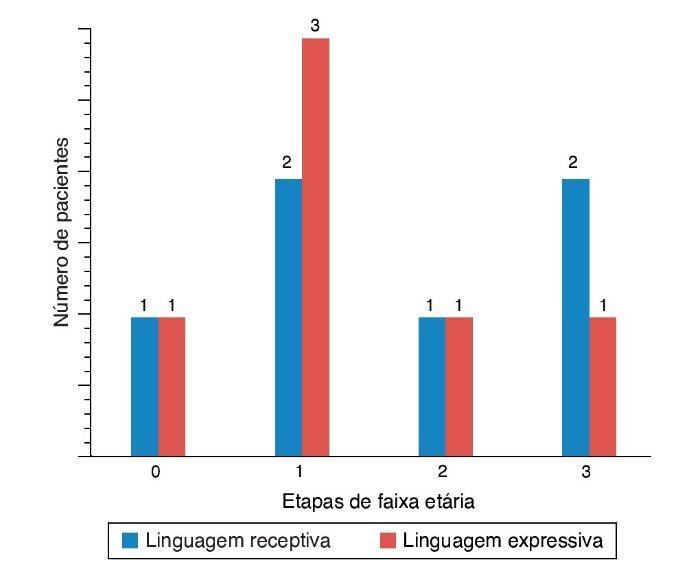
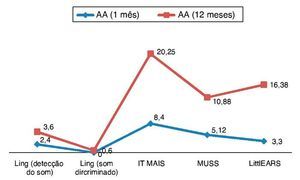
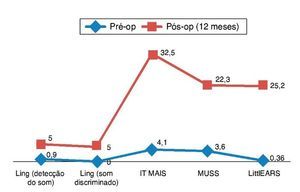
Para a avaliação das habilidades de percepção auditiva, as pontuações de Ling, IT MAIS, MUSS e LittlEARS foram deter-minadas um e 12 meses após a adaptação do aparelho, dependendo dos dados de disponibilidade. Todos os pacientes com acompanhamento suficiente até a data apresentaram melhora significativa devido aos aparelhos auditivos (p < 0,05) (fig. 4). Para a avaliação do desenvolvimento da lingua-gem, as pontuações da PLS-4 foram determinadas por meio da adaptação dos aparelhos auditivos um e 12 meses após a colocação do mesmo, dependendo da disponibilidade de dados. Todos os pacientes com acompanhamento suficiente até a data apresentaram melhora significativa devido aos aparelhos auditivos (p < 0,05) (fig. 5).
Figura 4. Resultados das pontuações das habilidades de percepção auditiva em ENA com aparelhos auditivos (AA).
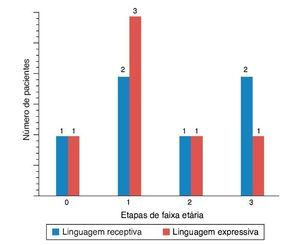
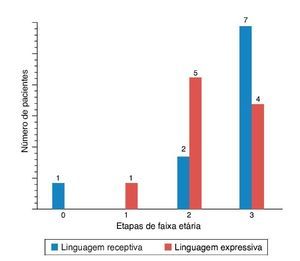
Figura 5. Resultados das pontuações PLS-4 em ENA com aparelhos auditivos (AA) (as pontuações PLS-4 foram mostradas como o progresso na faixa etária por etapas).
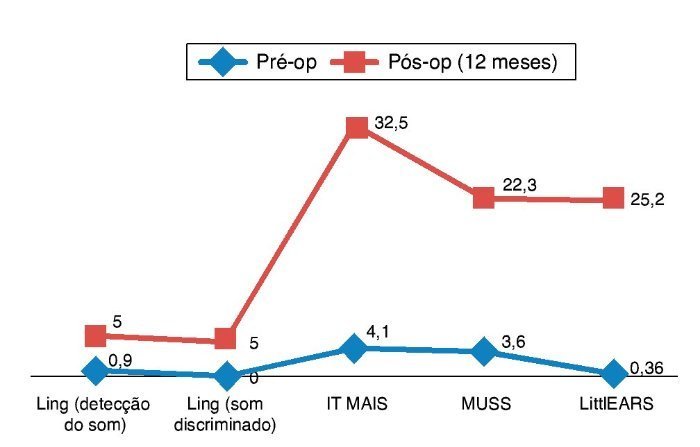
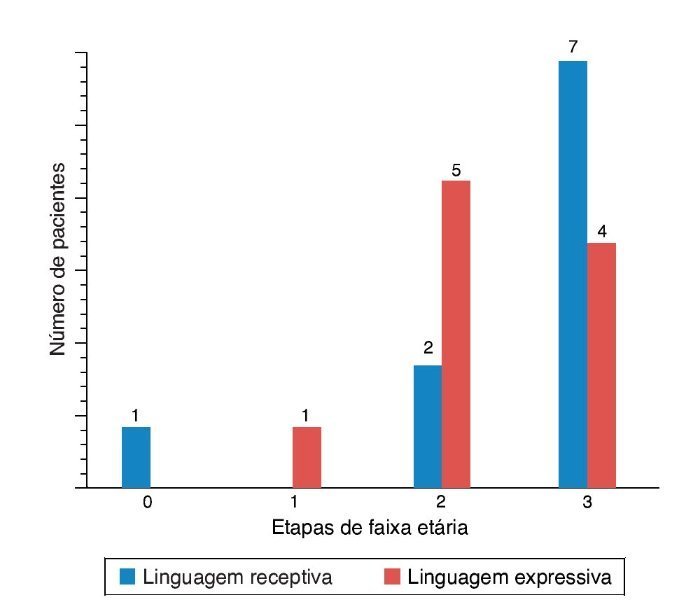
Para a avaliação das habilidades de percepção auditiva, as pontuações de Ling, IT MAIS, MUSS e LittlEARS foram deter-minadas antes dos implantes cocleares e 12 meses após a adaptação do implante coclear, dependendo da disponibili-dade de dados. Todos os pacientes com acompanhamento suficiente até a data apresentaram melhora significativa devido aos aparelhos auditivos (p < 0,05) (fig. 6). Para avaliação do desenvolvimento da linguagem, as pontuações da PLS-4 foram determinadas antes dos implantes cocleares e 12 meses após a adaptação aos aparelhos, dependendo da disponibilidade de dados. Todos os pacientes com acompanhamento suficiente até a data apresentaram melhora significativa devido ao IC (p < 0,05) (fig. 7). Não houve diferença no efeito do ENA sobre os resultados entre os pacientes usando aparelhos auditivos e aqueles usando IC (p > 0,05).
Figura 6. Resultados das pontuações das habilidades de percepção auditiva em ENA com IC.
Figura 7. Resultados das pontuações da PLS-4 em ENA com IC (as pontuações da PLS-4 foram mostradas como o progresso na faixa etária por etapas).
Discussão
O termo neuropatia auditiva foi usado pela primeira vez por Sininger e colegas, em 1995, e, atualmente, é o termo mais popularmente usado para definir a condição clínica. Deve-se entendê-lo como um termo consensual usado por pesquisadores para descrever o estado clínico da perda auditiva caracterizada por ABR ausente com EOA e MC normais.1
Os pacientes que preenchem os critérios para a definição de neuropatia auditiva representam uma população heterogênea, como em nosso estudo. Na verdade, é bem possível que nem todos os pacientes com os critérios clínicos para essa doença tenham o mesmo mecanismo patológico para sua deficiência auditiva. É provável que existam diversas razões que expliquem os achados clínicos da neuropatia auditiva.3,5,9,12-16 Os pacientes de nosso estudo também apresentaram variados fatores etiológicos ou predisponentes do ENA. A prevalência foi de hiperbilirrubinemia, detectada em 15% dos pacientes em nosso estudo e em 10% a 50% daqueles das séries relatadas.17-19 A consanguinidade é muito comum em algumas populações na Turquia, e está associada a uma variedade de distúrbios congênitos, incluindo perda auditiva e ENA, como em nosso estudo.20 Em estudos anteriores, suspeitou-se que fatores genéticos estivessem envolvidos na patogênese do ENA. Bonfils et al. relataram parentes com um padrão hereditário dominante de perda auditiva progressiva com características semelhantes às do ENA.21 Leonardiset et al. descobriram uma família cigana com neuropatias sensorial e motora hereditárias, associadas ao ENA.22 Madden et al. levantaram a hipótese de um padrão de herança recessiva com base no estudo de três famílias com dois filhos afetados e duas outras crianças com história familiar positiva para perda auditiva.23 Portanto, em nosso estudo, pensamos que os dois irmãos com ENA poderiam compartilhar um fator genético. Múltiplas etiologias possíveis para ENA foram propos-tas. A estimativa é que a metade dos casos seja idiopática.10 Em nosso estudo, em 54% dos pacientes, a etiologia do ENA, era desconhecida.
A avaliação audiológica de pacientes com suspeita de neuropatia auditiva deve ser abrangente e incluir os seguintes critérios:
1. Perda auditiva, geralmente bilateral, de qualquer grau;
2. Presença de EOA e/ou MM;
3. ABR anormal ou ausente;
4. Má percepção da fala;
5. Reflexos acústicos ausentes.23
A característica diagnóstica do ENA é a combinação de atividade normal das células ciliadas externas e anormalidade das funções neuronais auditivas aferentes e eferentes, provavelmente no nível do oitavo nervo craniano e tronco cerebral. A ativação das células ciliadas externas é avaliada indiretamente pela energia acústica emitida pela orelha interna (EOA) e pela resposta elétrica da cóclea (MC).10 Segundo alguns autores, 80% dos pacientes apresentam EOA, mas que desaparecem ao longo do tempo em 11% dos seus pacientes. EOA não foi registrada em outros 9%.24 Raveh relatou que, em três de seus pacientes, EOA estava ausente e MC estava presente.10 Em nosso estudo, descobrimos que EOA estava ausente em 34 pacientes, e MC estava bilateralmente presente em seis; unilateralmente, EOA estava ausente e MC estava presente.
Na perda auditiva coclear, EOA e MC estão ausentes e, consequentemente, o limiar de ABR é elevado. No entanto, em ENA, ABR está anormal ou ausente, ao passo que a EOA e/ou MC são normais. Casos de ABR ausente na presença de perda auditiva leve a moderada foram relatados em algumas séries.3,10 ABR em ENA, que é pior, é aceito em PANS coclear, muito provavelmente porque a sincronia é insuficiente para evocar atividade neural auditiva em tronco encefálico.24
Alguns pesquisadores relatam que a maioria dos pacientes com ENA apresenta reflexo acústico ausente, com cerca de 20% apresentando reflexo acústico altamente atípico (elevado), tanto ipsilateral quanto contralateralmente, mas reflexo acústico gravável à estimulação tátil.24 Em nosso estudo, os pacientes com ENA não apresentaram reflexos acústicos.
A perda auditiva no ENA pode variar de leve a profunda, e os audiogramas variam bastante; nenhum padrão predominante foi detectado.25,26 O grau de perda auditiva em pacientes com diagnóstico de neuropatia auditiva variou de leve a profundo; a maioria das perdas foi bilateral e simétrica na configuração (82%), com poucos pacientes apresentando audição normal em ambas as orelhas e um distúrbio unilateral.24 Em nosso estudo, a maioria dos pacientes apresentou perda auditiva de grave a profunda (12% grave – 48% profunda). Dois dos pacientes com ENA (5%) apresentaram nível de audição normal.
Em decorrência do entendimento ainda incipiente do ENA, a amplificação e a reabilitação auditiva desses pacientes são um desafio. Para os pacientes pediátricos, recomenda-se uma abordagem abrangente e multidisciplinar. Estudos sobre a amplificação com aparelhos auditivos executados de acordo com as informações audiológicas são necessários. O sistema de FM também pode ser tentado. Os sistemas de FM são recomendados em tanto em pacientes com ENA com audição normal quanto em pacientes com aparelho auditivo, e em usuários de implante coclear, devido à melhora da compreensão da fala em condições ruidosas. Acredita-se que esses aparelhos aumentem o sucesso escolar. Além disso, quando a equipe de implante coclear avalia o paciente, deve deter-minar se ele é candidato ao uso de um implante coclear, com base nos resultados audiológicos, benefício do aparelho, estado de desenvolvimento da fala e desenvolvimento geral das habilidades.27 Em nosso estudo, em 15 pacientes com ENA com perda auditiva profunda, os implantes cocleares foram adequados; 23 pacientes foram acompanhados com aparelhos auditivos; e os dois restantes que apresentavam nível de audição normal receberam indicação de uso do sistema de FM, mas os pais não aceitaram.
A reabilitação auditiva com aparelhos é difícil para pacientes com ENA, devido ao pouco reconhecimento das palavras.15 No entanto, a próteses auditivas com ou sem o sistema de FM devem ser a primeira etapa do tratamento. Em alguns casos, nos quais o nível de perda de audição tonal é muito pequena ou normal, como em nosso paciente com nível de audição normal, o sistema de FM pode ser executado ou um aparelho auditivo de baixo ganho pode ser usado para aumentar a sincronização auditiva. Na série de Raveh, apenas em um de 19 pacientes a amplificação mostrou-se útil, com desenvolvimento da fala.10 Rance et al. demonstraram que quase 50% das crianças com ENA foram beneficiadas com a amplificação.26 Em nosso estudo, uma melhora significativa foi observada entre os períodos anterior e posterior ao uso de próteses auditivas.
O implante coclear fornece estimulação elétrica suprafisiológica para o nervo auditivo e pode melhorar a sincronia da atividade neural.10 Estudos relataram melhor desempenho audiológico, e bons implantes evocaram respostas eficientes do tronco encefálico, bem como boa telemetria de resposta neural (TRN).10,15,23,28 Quinze dos nossos pacientes que falharam no tratamento com aparelhos auditivos se adequaram aos implantes cocleares. A TRN estava dentro dos limites normais no intra e no pós-operatório. Todos os pacientes apresentaram melhora significativa com acompanhamento adequado. No entanto, observamos que, estatisticamente, não houve diferença entre os grupos em relação ao uso de aparelhos auditivos e o uso de implante coclear, pois todos os usuários de implante coclear com ENA apresentavam perda auditiva profunda, semelhante a outros implantados. O resultado foi similar aos de usuários de aparelhos auditivos, porque a maioria deles apresentava perda auditiva leve ou moderada. Assim, não foi possível descobrir diferença nos resultados de percepção auditiva e desenvolvimento da linguagem entre as crianças com ENA e as com PANS que usavam aparelhos auditivos e IC.
Conclusão
Uma avaliação audiológica abrangente é necessária para um diagnóstico preciso. O melhor tratamento do ENA é proporcionado pela abordagem multidisciplinar, e a forma de amplificação deve ser escolhida de acordo com o grau de perda auditiva, desenvolvimento da linguagem e da perda auditiva neurossensorial.
Autoria
Çağıl Gökdoğan participou da coleta e análise dos dados e da redação do trabalho; Şenay Altınyay participou da coleta e análise dos dados e da redação do trabalho; Bülent Gündüz participou da coleta e análise dos dados e da redação do trabalho; Yusuf Kemal Kemaloğlu participou da redação do trabalho; Yıldırım Bayazıt participou da redação do trabalho; e Kemal Uygur participou da redação do trabalho.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Recebido em 8 de março de 2015;
aceito em 21 de agosto de 2015
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.08.022
☆ Como citar este artigo: Gökdoğan Ç, Altınyay Ş, Gündüz B, Kemaloğlu YK, Bayazıt Y, Uygur K. Management of children with auditory neuropathy spectrum disorder (ANSD). Braz J Otorhinolaryngol. 2016;82:493-9.
* Autor para correspondência.
E-mail:cagilgokdogan@gmail.com (Ç. Gökdoğan).