Many studies have been done on proteomics, genomics, epigenetic, immunogenetics in many body fluids. Among these, circulating cell‐free DNA (ccfDNA) entered the literature in 1948, but it has not been studied for many years due to technological deficiencies. Following recent advances, geno‐metastasis has been mentioned and new research is needed in this area. ccfDNA is known to be an important biomolecule in this regard.
ObjectiveThe presence of cell‐free DNA in the circulatory system may offer a tremendous opportunity to provide novel biomarkers for thyroid diseases. This experimental study was conducted to determine the amount of ccfDNA in different thyroid diseases, then to evaluate whether the ccfDNA concentration varied between the disease groups and control group.
MethodsIn total, we included 121 individuals in the present study. We collected blood samples and then determined the ccfDNA concentration in plasma of collected blood samples from three groups: thyroiditis (n=33), benign (n=37), and malignant (n=30) and from a control group (n=21).
ResultsThe median values of the ccfDNA groups were found as 1610, 1665, 1685 and 576ng/mL for the thyroiditis, benign, malign, and control groups, respectively. Findings showed that the ccfDNA of the three groups was significantly higher than the control (p<0.0001). Each group was compared in terms of ccfDNA and the p‐values of benign‐thyroiditis, benign‐malign, and thyroiditis‐malign were 0.09, 0.65, and 0.29, respectively.
ConclusionsThe clear differences between thyroid diseases and controls suggest that ccfDNA is worthy of attention as a biomarker for further evaluation of different thyroid diseases. Likewise, it might indicate a clear tendency that ccfDNA can also be used to distinguish different thyroid diseases.
Muitos estudos foram realizados em proteômica, genômica, epigenética e imunogenética em vários fluidos corporais. Entre esses, o DNA circulante livre de células (cfDNA) despontou na literatura em 1948, mas não foi estudado por muitos anos devido a deficiências tecnológicas. Após recentes avanços, a genometástase é mencionada e novas pesquisas tornam‐se necessárias nessa área. Nesse sentido, o cfDNA é conhecido por ser uma importante biomolécula.
ObjetivoA presença de DNA livre de células no sistema circulatório pode oferecer uma excelente oportunidade para fornecer novos biomarcadores para doenças da tireoide. Este estudo experimental foi conduzido para determinar a quantidade de cfDNA em diferentes doenças da tireoide e então avaliar se a concentração de cfDNA variou entre os grupos com doença e o grupo controle.
MétodoNo total, 121 indivíduos foram incluídos no estudo. Coletamos amostras de sangue e, em então, determinamos a concentração de cfDNA no plasma de amostras de sangue de três grupos: tireoidite (n=33), benigno (n=37) e maligno (n=30) e de um grupo controle (n=21).
ResultadosAs medianas dos valores dos grupos de cfDNA foram de 1.610, 1.665, 1.685 e 576ng/mL para os grupos tireoidite, benigno, maligno e controle, respectivamente. Os achados mostraram que o cfDNA dos três grupos com doença era significativamente maior do que o do grupo controle (p<0,0001). Cada grupo foi comparado em termos de cfDNA e os p‐valores de benigno‐tireoidite, benigno‐maligno e tireoidite‐maligno foram de 0,09, 0,65 e 0,29, respectivamente.
ConclusõesComo resultado, as óbvias diferenças entre as doenças da tireoide e os controles sugerem que o cfDNA é digno de atenção como um biomarcador para avaliação adicional das diferentes doenças da tireoide. Da mesma forma, isso pode indicar uma clara tendência de que o cfDNA também pode ser utilizado para distinção das diferentes doenças da tireoide.
Estima‐se que 6,71% da população europeia e 4,78% da população dos Estados Unidos da América (EUA) com distúrbios da tireoide não tenham sido diagnosticados,1 o que representa metade do número de pessoas com a doença.2 Um estudo feito nos EUA mostrou que 4,6% e 1,3% dos indivíduos foram diagnosticados com hipotireoidismo e hipertireoidismo, respectivamente, na triagem de 13.344 indivíduos com doença tireoidiana previamente desconhecida.3 Achados semelhantes observados em um estudo de metanálise mostraram que 4,94% e 1,72% dos indivíduos foram diagnosticados com hipotireoidismo e hipertireoidismo, respectivamente.4
Disfunções da tireoide e o hipotireoidismo tornaram‐se mais comuns nos últimos anos na faixa da meia‐idade e em mulheres, como resultado do aumento da inflamação da tireoide. A tireoidite é avaliada em três categorias, de acordo com o seu tempo de cura: aguda (início rápido e curta duração), subaguda (com duração de menos de um ano) e crônica (ao longo da vida). A tireoidite de Hashimoto é uma doença crônica da tireoide, é a inflamação potencialmente fatal mais comum da tireoide. Embora a causa não seja completamente conhecida, alguns fatores, inclusive o uso de sal iodado, infecções e exposição à radiação, são considerados efetivos no desenvolvimento da tireoidite de Hashimoto.
Entre as doenças da tireoide, 3% a 7% das pessoas que apresentam nódulos na tireoide têm um distúrbio tireoidiano. Segundo as pesquisas, a maioria desses nódulos representa tumores benignos e 5% a 8% deles podem se converter em tumores malignos,5 os quais são os tumores mais comuns do sistema endócrino. A significância clínica dos nódulos tireoidianos baseia‐se na necessidade de excluir o câncer de tireoide, que é visto em 7% a 15% dos casos, depende de idade, sexo, história de exposição à radiação, história familiar e outros fatores.6,7 Existem quatro tipos principais de câncer da glândula tireoide. Esses são, por ordem de frequência: carcinoma papilar, folicular, medular e anaplásico. Um número considerável de casos de câncer é de células foliculares.5 O carcinoma diferenciado de tireoide (CDT), inclusive o carcinoma papilífero e folicular, constitui a maioria (> 90%) de todos os casos de câncer de tireoide.8
Atualmente, a biópsia por punção aspirativa com agulha fina (PAAF) é usada para diagnosticar e tratar tumores malignos, mas há uma taxa de falha de 20% devido à falta de espécime adequado e tecido específico, técnicas citológicas e métodos diferentes usados pelos técnicos. Portanto, há a necessidade de novos biomarcadores mais confiáveis, capazes de diagnosticar o câncer de tireoide de forma precoce e definitiva, que possam ser medidos de maneira não invasiva, fácil e precisa. Para esse propósito, muitos estudos foram feitos em proteômica, genômica, epigenética, imunogenética e outras moléculas em vários fluidos corporais. Entre estes, o DNA circulante livre de células (cfDNA) despontou na literatura em 1948, mas não foi estudado por muitos anos devido a inadequações tecnológicas. Após os recentes avanços tecnológicos, o mecanismo de metástase começou a ser discutido novamente e a menção da genometástase, o que levou à necessidade de novas pesquisas nessa área. O cfDNA é conhecido por ser uma importante biomolécula nesse sentido. Essa molécula ganha destaque em muitas doenças, principalmente em estudos de câncer em nível genético e epigenético, em relação ao tipo de câncer, desenvolvimento, quantidade de plasma sanguíneo e outras moléculas no plasma. Por exemplo, esses dados são muito promissores para determinar se uma pessoa tem ou não câncer e se o câncer apresentou metástase no corpo, se o sucesso foi alcançado após o tratamento e se a cirurgia é necessária.
No presente estudo, objetivamos medir a quantidade de cfDNA em amostras de plasma coletadas de indivíduos com doenças da tireoide e indivíduos saudáveis e então comparar a quantidade de cada grupo. A feitura deste estudo será uma contribuição importante para determinar se o nível de cfDNA pode ser usado como um biomarcador molecular para diferentes doenças da tireoide.
MétodoO presente estudo foi feito em amostras de sangue de 100 pacientes com doenças da tireoide. Dos 100 pacientes incluídos em nosso estudo, 33 tinham doenças tireoidianas, 37 apresentavam nódulo tireoidiano benigno e 30 tinham câncer de tireoide. Para o grupo controle, foram incluídos 21 pacientes sem doenças adicionais conhecidas. Fizemos exames adicionais nos pacientes com nódulos ou massas na tireoide. Os pacientes foram diagnosticados através de ultrassonografia (USG) da tireoide, seguida por PAAF; no entanto, alguns pacientes com câncer foram definitivamente diagnosticados após serem submetidos a cirurgia. Apenas pacientes com doenças tireoidianas foram avaliados no presente estudo. Antes da coleta de amostras de sangue periférico, os pacientes e controles foram informados sobre o estudo e seus objetivos e então, cada um deles forneceu seu consentimento informado, assinou o formulário apropriado. As características dos pacientes e controles foram obtidas através de um questionário padronizado. Aprovação ética foi concedida pelo Comitê de Ética da Faculdade de Medicina (27/2016‐E.70096).
Para o cfDNA, 5mL de sangue foram coletados em tubos esterilizados com K3‐EDTA. Depois de coletar as amostras de sangue, elas foram imediatamente centrifugadas a 3.000g por 10min. As amostras de plasma foram transferidas para outro tubo estéril, sem DNAse e as amostras foram centrifugadas a 16.000g por 10min. Em seguida, as amostras de plasma foram separadas e armazenadas a ‐80°C para estudo posterior. O conteúdo de DNA das amostras de plasma foi medido diretamente com um kit de ensaio de DNA de alta sensibilidade Quant‐iT™ baseado em fluorescência e um fluorômetro Qubit® (Invitrogen, Carlsbad, CA, EUA). O fluorômetro Qubit® 2.0 é usado para quantificação de DNA, RNA e proteína. Ele usa colorações específicas para cada tipo de molécula que tem fluorescência extremamente baixa até se ligarem a seus alvos. Após a ligação, elas emitem um sinal intensamente fluorescente que é diretamente proporcional à concentração de DNA de qualquer solução. No presente estudo, o cfDNA de cada indivíduo foi medido com uma curva de DNA obtida a partir do padrão de DNA de concentrações conhecidas. As amostras de plasma foram analisadas em duplicata e a média dos dois valores foi usada como a quantidade final de DNA. As medidas intermediárias e os coeficientes de variação deste ensaio foram inferiores a 1,00%.
Diferenças entre os grupos foram detectadas com one‐way Anova e depois Bonferroni como teste post hoc. As diferenças entre homens e mulheres foram analisadas pelo teste U de Mann‐Whitney. Os níveis de significância foram indicados. Os efeitos dos fatores de confusão (idade, sexo, tabagismo, hábitos etc.) também foram avaliados estatisticamente. A contribuição de cada fator levado em consideração foi avaliada com análise de regressão múltipla. Possíveis associações foram investigadas com a correlação de Pearson. O programa SPSS 18.0 foi usado para cálculos estatísticos.
ResultadosA distribuição por idade e sexo de cada grupo é apresentada na tabela 1. A maioria dos pacientes em nosso estudo era do sexo feminino. Trinta (90,9%) tinham tireoidite e 64,9 (24%) apresentavam nódulos benignos. Vinte e três (76,7%) dos pacientes com malignidade eram do sexo feminino. A média de idade foi de 37,6 para aqueles com doenças da tireoide, 54,1 para aqueles com nódulos benignos e 47,8 para pacientes com câncer.
Características das populações
| Controle(n = 21) | Tireoidite(n = 33) | Benigno(n = 37) | Maligno(n = 30) | |
|---|---|---|---|---|
| Idade | 30,1 ± 15,2 | 37,6 ± 10,9 | 54,1 ± 13,1 | 47,8 ± 11,9 |
| Sexo masculino | 29,8 ± 15,8 (43%) | 47,3 ± 7,5 (10%) | 58,9 ± 10,1 (33%) | 46,1 ± 13,4 (23%) |
| Sexo feminino | 30,4 ± 15,4 (47%) | 36,7 ± 10,8 (90%) | 51,7±13,9 (67%) | 48,3 ± 11,8 (77%) |
No caso de tabagismo e uso de álcool, 8 (23,5%) dos pacientes com doenças da tireoide eram usuários ativos, 6 (17,8%) eram ex‐usuários e 7 (20,5%) relataram uso de álcool ativo. Entre os pacientes com lesão maligna, 13 (43,3%) eram usuários ativos, 3 (10%) tinham histórico de consumo prévio de álcool e 7 (23,3%) consumiam álcool atualmente. Nos pacientes com nódulos benignos, 6 (15,7%) pacientes relataram hábito ativo de uso de cigarros, 6 (15,7%) pacientes eram ex‐usuários e 4 (10,5%) relataram consumo contínuo de álcool. O grupo controle consistiu em 9 (42,85%) homens e 12 (57,14%) mulheres. A média de idade foi de 30,1 anos no grupo controle.
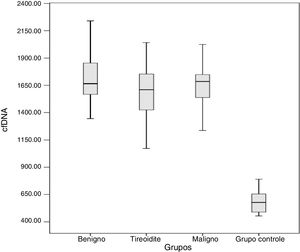
Os resultados obtidos para o cfDNA em cada grupo são apresentados na tabela 2 e na figura 1. De acordo com os resultados obtidos, os valores mínimos e máximos de cfDNA nos pacientes foram 908 a 2.280 ng /mL para tireoidite, 1.344 a 2.560 ng/mL para nódulo benigno, 1.212 ± 2840 ng/mL para nódulo maligno e 454 a 1.018 ng/mL para os controles. Os valores médios de cfDNA nos grupos foram 1.610, 1.665, 1.685 e 576 ng/mL para os grupos tireoidite, nódulo benigno, nódulo maligno e controles, respectivamente.
cfDNA nos grupos com doença e grupo controle
| cfDNA | Controle(n = 21) | Tireoidite(n = 33) | Benigno(n = 37) | Maligno(n = 30) |
|---|---|---|---|---|
| Média total | 623,3 ± 172,9 | 1613 ± 284 | 1721,3 ± 243 | 1691 ± 292 |
| Mínimo | 454 | 908 | 1344 | 1212 |
| Máximo | 1081 | 2280 | 2560 | 2840 |
| Sexo masculino | 608,0 ± 120 | 1667 ± 217 | 1825 ± 310 | 1687 ± 251 |
| Sexo feminino | 634,8 ± 208 | 1608 ± 292 | 1664 ± 181 | 1692 ± 309 |
Os quatro grupos, inclusive controles, nódulo maligno, nódulo benigno e tireoidite, foram comparados com one‐way Anova e em seguida teste de Bonferroni como um teste post hoc. De acordo com os resultados obtidos, o cfDNA foi significantemente maior nos três grupos de pacientes do que nos controles (p < 0,0001 para todos os grupos). Cada grupo foi comparado em termos de cfDNA e os valores de p de nódulo benigno‐tireoidite, nódulo benigno‐nódulo maligno e tireoidite‐nódulo maligno foram 0,09, 0,65 e 0,29, respectivamente.
O cfDNA de homens com tireoidite foi ligeiramente maior do que nas mulheres; no entanto, essa diferença não atingiu um nível significante (p = 0,7). Os pacientes com tireoidite que eram fumantes (1.658 ng/mL) apresentaram maior concentração de cfDNA quando comparados com pacientes não fumantes (1.599 ng/mL). No entanto, a diferença não foi estatisticamente significante (p > 0,05). A análise não revelou correlação entre o cfDNA e a idade. A análise de regressão linear mostrou que o cfDNA não foi afetado por fatores de confusão, como idade, sexo, tabagismo e hábito de consumir álcool (p > 0,05).
Nesse grupo, há uma clara tendência de significância para os homens (1.825 ng/mL) em relação às mulheres (1.664 ng/mL) em termos de cfDNA (Teste U de Mann‐Whitney, p = 0,054). A quantidade de cfDNA em fumantes e não fumantes é semelhante e, portanto, não há relação entre o tabagismo e o cfDNA. Observou‐se que o cfDNA em indivíduos com nódulos benignos não se correlacionou com a idade (p > 0,05). A análise de regressão linear indicou que o sexo pode afetar o cfDNA em pacientes com nódulos benignos no modelo ajustado por idade, sexo, tabagismo e hábito de consumir álcool (p = 0,08).
Em termos de gênero, não há diferença entre homens e mulheres. Da mesma forma, observou‐se que o cfDNA de fumantes e não fumantes é semelhante. No grupo com nódulo maligno, não observamos qualquer correlação entre o cfDNA e a idade. Na análise de regressão, não foram determinados fatores potenciais que afetassem a quantidade de cfDNA nas amostras de plasma.
Em um grupo com três doenças diferentes, o cfDNA do sexo masculino (1.762 ng/mL) foi maior do que o feminino (1.651 ng/mL), que apresentou uma tendência a ser significante (p = 0,08). Em relação ao tabagismo, a quantidade de cfDNA de fumantes e não fumantes foi muito próxima (p > 0,05). De acordo com a correlação de Spearman, o cfDNA está positivamente correlacionado com a idade em um nível significante (r = 0,21, p < 0,05). Nos modelos de regressão multivariada ajustados por idade, sexo, tabagismo e etilismo, o cfDNA não se associou a qualquer dos fatores presentes nos modelos. Após o método de regressão ter sido aplicado à mesma análise, a idade foi o único fator que afetou o cfDNA na doença da tireoide.
DiscussãoEm muitas doenças, especialmente para o câncer, é crucial encontrar amostras substitutas devido à condição invasiva de obtenção das amostras. Hoje, é bem conhecido o fato de que o cfDNA pode ser medido em indivíduos saudáveis em fluidos corporais, inclusive plasma, soro, escarro e urina.9 Por outro lado, o cfDNA também pode ser encontrado em níveis mais elevados em outras doenças, inclusive doenças autoimunes, vários tipos de câncer e doenças cardiovasculares.9–11 Mais especificamente, a caracterização do cfDNA em relação às suas mutações, alterações epigenéticas, tamanho e distribuição dos fragmentos tem sido associada a vários tipos de câncer.12 Assim, biomarcadores não invasivos nos permitem acompanhar o diagnóstico, o prognóstico e o monitoramento de doenças.
Embora a origem do cfDNA não seja clara, existem vários mecanismos que contribuem para a quantidade de DNA circulante. Os mecanismos que contribuem para o cfDNA podem mudar, depende do tipo e/ou estágio da doença. Acredita‐se que as células mortas ou moribundas são a principal fonte de cfDNA. No entanto, também já foi demonstrado que células vivas podem liberar cfDNA. Além disso, a quantidade em circulação pode variar, depende do estágio da doença. Acima de tudo, a quebra celular, a apoptose, a necrose, o exossomo e os virossomos são aceitos como os principais mecanismos. Em um modelo sugerido, supõe‐se que haja três eventos responsáveis pelo cfDNA no sangue de um paciente com câncer, inclusive necroptose, apoptose e secreção pelo tumor e macrófagos.13 Devido a esses eventos, o cfDNA pode ser liberado em cadeia simples ou dupla e, a depender do tipo de tumor, diferentes formas de cfDNA podem ser liberadas.13
No presente estudo, determinamos que o cfDNA medido nos grupos com três tipos diferentes de doenças da tireoide foi consistentemente e significantemente maior do que no grupo controle. Observamos que o cfDNA nos grupos com tireoidite, tumor benigno e tumor maligno foi 2,59, 2,76 e 2,72 vezes maior do que no grupo controle. Portanto, apresentamos a quantidade de cfDNA em amostras de plasma como um novo biomarcador de doenças da tireoide. Entre as doenças da tireoide, não houve diferenças claras. No entanto, a maior quantidade de cfDNA nos casos benignos comparados com o grupo com tireoidite pode indicar que o cfDNA pode ser usado para mostrar a diferença entre as doenças da tireoide.
A lógica por trás do câncer de tireoide ainda não é totalmente compreendida. No entanto, tem sido sugerido que existem vários fatores, inclusive radiação, poluição ambiental e nutrição, que levam o indivíduo a ter propensão ao câncer de tireoide. Todas as causas multifatoriais têm a capacidade de induzir mecanismos apoptóticos.14 Como indicado acima, a exposição ambiental pode afetar os mecanismos associados à quantidade de cfDNA.15 Os mecanismos relacionados à liberação de cfDNA também estão associados a doenças da tireoide. Por exemplo, foi afirmado que a apoptose está associada à homeostase da glândula tireoide. Isso também desempenha um papel nos mecanismos de tireoidite autoimune e no câncer de tireoide.16 A esse respeito, a maior quantidade de cfDNA encontrada no presente estudo pode ser atribuída a mecanismos apoptóticos. Em outro estudo, houve uma diferença significante no índice de integridade do cfDNA entre pacientes com nódulos benignos e pacientes com carcinoma de tireoide confirmados por citologia. Esse achado apoia o uso do cfDNA como um biomarcador promissor para o diagnóstico de nódulos tireoidianos.17 Em nosso estudo, incluímos esses pacientes, além do acompanhamento de pacientes com doença da tireoide (tireoidite).
O aumento anormal da quantidade de cfDNA no soro e plasma de pacientes com câncer foi detectado pela primeira vez em 1977.18 Entretanto, o uso do prognóstico e diagnóstico como um marcador foi abordado apenas recentemente.19 Em um grande grupo de cânceres, inclusive colorretal, pâncreas, pulmão, bexiga, região inferior do pescoço e fígado, foram detectadas mutações de DNA livre no cfDNA.20–25 Várias alterações do DNA foram relatadas no DNA livre, inclusive mutações de ponto, hipermetilação de DNA, instabilidade de microssatélites (IM) e perda de heterozigose (LOH) (A). Em muitos casos, essas alterações são as mesmas encontradas no local do tumor primário do paciente e apoiam a origem tumoral do DNA livre alterado. As alterações no cfDNA não estão restritas a alguma região, espécie ou grau tumoral particular. No entanto, os pacientes com doença em estágio final e metástase tendem a ter níveis significativamente mais elevados de cfDNA. Assim, no presente estudo, o cfDNA também pode fornecer um recurso valioso de material genético como um substituto para a análise molecular em doenças da tireoide.
Sabe‐se que um corpo maior de dados pode fornecer resultados mais precisos em um estudo desse tipo. O número baixo de participantes é um aspecto limitante do nosso estudo. Apesar dessa situação, as diferenças estatisticamente significantes entre os grupos de doenças e os controles apoiam o uso do cfDNA como características distintas das doenças da tireoide que poderiam ser usadas para o diagnóstico, prognóstico e monitoramento de doenças.
ConclusãoAs diferenças entre as doenças da tireoide e o grupo controle sugerem que o cfDNA deve ser considerado como um biomarcador para avaliação adicional das doenças tireoidianas. Além disso, oferecemos várias sugestões. Primeiro, é importante desenvolver abordagens quantitativas para determinar a carga de alterações de DNA no cfDNA e estabelecer um limite de detecção mais baixo para as metodologias usadas. Isso será crucial para determinar os valores de corte para a significância da determinação das alterações no DNA. Em segundo lugar, os trabalhos futuros devem considerar a incorporação de diferentes genes e tipos de modificação para aumentar a sensibilidade e a especificidade para a detecção do câncer. Terceiro, comparações sistemáticas entre diferentes cânceres devem ser feitas para determinar se alguns tipos de câncer são mais propensos a liberar o cfDNA modificado do que outros. Quarto, é muito importante desenvolver pesquisas em grande escala baseados em estudos de caso‐controle e/ou estudos prospectivos, em vez de analisar casos clínicos recrutados sequencialmente. Quinto, a transformação de estudos experimentais de cfDNA em prática epidemiológica e clínica requer o desenvolvimento de instrumentação e métodos adaptados à análise de baixo custo em grande escala de mutações no DNA em quantidades muito pequenas. Dado o potencial para o manejo de cfDNA no câncer, esses desenvolvimentos podem rapidamente levar a importantes aplicações na detecção, no diagnóstico, prognóstico e acompanhamento de câncer.
FinanciamentoEste trabalho recebeu apoio financeiro da Çanakkale Onsekiz Mart University, Unidade de Coordenação de Pesquisa Científica (BAP), número do projeto: TYL‐2017‐1114.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Caglar O, Cilgin B, Eroglu M, Cayir A. Evaluation of circulating cell free DNA in plasma as a biomarker of different thyroid diseases. Braz J Otorhinolaryngol. 2020;86:321–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.