A vertigem posicional paroxística benigna é um distúrbio vestibular comum, responsável por um quinto das internações hospitalares por vertigem, embora seja comumente não diagnosticada.
ObjetivoAvaliar os efeitos da terapia adjuvante com betaistina no tratamento de indivíduos com vertigem posicional paroxística benigna posterior.
MétodoEste estudo randomizado controlado foi feito em uma população de 100 indivíduos com vertigem posicional paroxística benigna posterior. Os indivíduos foram divididos nos grupos: manobra de Epley+betaistina (grupo A) e manobra de Epley apenas (grupo B). Os indivíduos foram avaliados antes e uma semana após a manobra por meio da escala visual analógica EVA e do questionário dizziness handicap inventory.
ResultadosCem indivíduos completaram o protocolo do estudo. A manobra de Epley demonstrou uma taxa de sucesso global de 95% (96% no grupo A; 94% no grupo B, p=0,024). Os grupos A e B tiveram escores basais semelhantes na EVA (6,98±2,133 e 6,27±2,148, respectivamente, p=0,100). Após o tratamento, o escore na EVA foi significantemente menor em ambos os grupos e foi menor no grupo A do que no grupo B (0,74±0,853 vs. 1,92±1,288, respectivamente, p=0,000). A mudança no escore da EVA após o tratamento em comparação com a linha basal também foi significativamente maior no grupo A do que no grupo B (6,24±2,01 vs. 4,34±2,32, respectivamente, p=0,000). Os valores basais no dizziness handicap inventory também foram semelhantes nos grupos A e B (55,60±22,732 vs. 45,59±17,049, respectivamente, p=0,028). Após o tratamento, eles foram significantemente menores em ambos os grupos. A mudança no escore após o tratamento em comparação com a linha basal também foi significantemente maior no grupo A do que no grupo B (52,44±21,42 vs. 35,71±13,51, respectivamente, p=0,000).
ConclusãoA manobra de Epley é eficaz no tratamento da vertigem posicional paroxística benigna. O tratamento complementar com betaistina na vertigem posicional paroxística benigna posterior resultou em melhoria tanto no escore da EVA quanto no do dizziness handicap inventory.
A vertigem posicional paroxística benigna (VPPB) é um distúrbio vestibular comum, responsável por um quinto de todas as hospitalizações por vertigens, embora seja comumente não diagnosticada.1,2 A forma mais comum é a idiopática e a VPPB tende a ocorrer em taxas mais elevadas em mulheres do que em homens.3 O principal mecanismo subjacente à VPPB é o acúmulo de otocônios (estruturas de carbonato de cálcio) no lúmen (canalolitíase) ou na cúpula (cupulolitíase) do canal semicircular, resulta em comprometimento da dinâmica dos fluidos do canal semicircular.4
Vários fatores foram investigados como possíveis causas da VPPB, inclusive enxaqueca, doença de Ménière, perda auditiva neurossensorial súbita idiopática, hábitos de sono, osteoporose/insuficiência de vitamina D, hiperglicemia/diabetes mellitus, deficiência de estrogênio, distúrbios neurológicos, alergias e outros.5,6 Independentemente da etiologia e do quadro clínico, as manobras de reposicionamento canalicular são a base do tratamento da VPPB com nível de evidência 1 no tratamento da VPPB.7 Embora os métodos usados pelos médicos sejam diferentes, as manobras de reposicionamento canalicular têm uma alta taxa de sucesso na VPPB. A qualidade de vida e o alívio da tontura são questões importantes durante o processo de cura. Algumas opções de tratamento médico estão disponíveis, inclusive a administração de betaistina.
A betaistina atua como um agonista fraco dos receptores H1 e como antagonista dos receptores H3.8 Ela é a principal opção de tratamento para a doença de Ménière. Entretanto, atualmente também é usada para tratar vários distúrbios vestibulares, bem como uma série de outras doenças, inclusive zumbido.9 Uma revisão recente da Cochrane indicou uma evidência de baixa qualidade em favor da betaistina para o tratamento da vertigem em vários estudos (razão de risco combinada para melhoria geral de 1,30).2 Isso destacou a necessidade de estudos clínicos adicionais para compreender a eficácia da betaistina em diferentes tipos de vertigem. Estudos anteriores produziram resultados conflitantes em relação ao uso terapêutico da betaistina na fase aguda da VPPB. O presente ensaio clínico randomizado foi conduzido para avaliar os efeitos da betaistina como terapia adjuvante em indivíduos tratados com a manobra de Epley.
MétodoEste ensaio clínico randomizado foi feito no Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço do Bakırköy Dr. Sadi Konuk Teaching and Research Hospital entre abril de 2019 e janeiro de 2020. A aprovação ética foi obtida do comitê de ética do hospital (2019/164) e todos os indivíduos forneceram o consentimento informado.
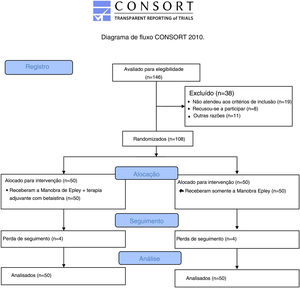
Após análise de poder, 146 indivíduos foram avaliados para inclusão no estudo. Trinta e oito indivíduos não atenderam aos critérios de inclusão (fig. 1). Dessa forma, foram incluídos 108 indivíduos com VPPB posterior diagnosticada pelo teste de Dix‐Hallpike. Os seguintes indivíduos foram excluídos: aqueles com VPPB anterior, VPPB lateral e idade <18 anos ou> 65 anos; com histórico de outras doenças vestibulares (doença de Ménière, neurite vestibular), distúrbios neurológicos (por exemplo, enxaqueca, órgãos circunventriculares), distúrbios psiquiátricos (depressão) e/ou doenças cardiovasculares ou cerebrovasculares concomitantes; com histórico de perda auditiva súbita ou cirurgias otológicas prévias (por exemplo, timpanoplastia, mastoidectomia); os que usaram medicamentos antivertiginosos, anti‐histamínicos, benzodiazepínicos, bloqueadores dos canais de cálcio e/ou diuréticos tiazídicos; e com limitações físicas que os tornam inadequados para a manobra de Epley (por exemplo, estenose cervical, síndrome de Down, doenças reumatológicas, lesões da medula espinhal).
Todos os sujeitos foram diagnosticados pela presença de nistagmo rotatório com inclinação ascendente provocado pela manobra de Dix‐Hallpike. Nenhuma ferramenta diagnóstica adicional foi usada. Após o diagnóstico, os indivíduos foram randomizados em grupo A (manobra de Epley+betaistina 24mg, v.o., duas vezes ao dia) e grupo B (manobra de Epley apenas). A manobra de Epley foi feita imediatamente após o teste de Dix‐Hallpike. Os escores da escala visual analógica (EVA) e do dizziness handicap inventory (DHI) foram avaliados antes da manobra. Nenhuma restrição posicional foi aplicada.
Os indivíduos foram avaliados uma semana após a manobra. O teste de Dix‐Hallpike foi feito para verificar a resolução completa do nistagmo provocado; se presente, uma segunda manobra de reposicionamento era feita e os indivíduos eram avaliados com o DHI e a EVA.
O DHI é a escala mais amplamente usada para avaliar os efeitos autopercebidos de deficiência impostos por doenças do sistema vestibular.10 O paciente responde “sim”, “às vezes” ou “não” a cada questão e os pontos fortes das respostas são indicados por valores numéricos de 0, 2 ou 4. O questionário tem 25 itens, de modo que o escore total pode variar de 0 a 100, escores mais altos indicam um maior grau de deficiência.
Análise estatísticaAs análises estatísticas foram feitas com o Number Cruncher Statistical System 2007 (NCSS, Kaysville, UT). Após o cálculo da estatística descritiva (médias, desvios‐padrão, medianas e intervalos), o teste t de Student e o teste χ2 foram usados para avaliar as diferenças entre os grupos de acordo com a idade e o sexo. A avaliação da presença de uma distribuição homogênea nos pacientes com tontura anterior entre os grupos com e sem tratamento com betaistina foi feita com o teste χ2. O teste t de Student foi usado para comparar os escores pré e pós‐tratamento na EVA entre os grupos com e sem betaistina. O teste U de Mann‐Whitney foi usado para comparar os escores do DHI pré e pós‐tratamento. O teste t de Student e o teste U de Mann‐Whitney foram usados para avaliar as diferenças nos escores da EVA e do DHI após o tratamento em comparação com os respectivos valores basais. Em todas as análises, p <0,05 foi considerado como significância estatística.
Análise de poderA análise de poder foi feita com o software Gpower 3.1.9.2 (Heinrich‐Heine‐Universität, Düsseldorf, Alemanha). Com base em Güneri et al., o tamanho do efeito foi calculado como 0,3.5 Para um poder de 0,80 com uma margem de erro de 0,05, 108 indivíduos foram necessários para o estudo.
ResultadosDurante o estudo, oito indivíduos foram perdidos no seguimento. Completaram o protocolo do estudo 100 indivíduos. A média de idade da população total do estudo foi 53,34±15,33 anos, e não houve diferenças significantes na média de idade entre o grupo A e o grupo B (55,68±14,534 vs. 50,96±15,911 anos, respectivamente, p=0,126). Eram do sexo masculino 42 indivíduos. Não houve diferenças significativas na distribuição por sexo entre os dois grupos (p=0,349). Haviam experimentado um crise de vertigem anterior 47 e não houve diferenças significantes na distribuição de crises de vertigem anteriores entre os dois grupos (p=0,270).
A manobra de Epley teve uma taxa de sucesso geral na população total do estudo de 95% (n=95), com taxas de 96% (n=48) no grupo A e 94% (n=47) no grupo B.
Os grupos A e B tinham escores basais semelhantes na EVA (6,98±2,133 vs. 6,27±2,148, respectivamente, p=0,100). Após o tratamento, o escore da EVA foi significativamente menor em ambos os grupos e foi significativamente menor no grupo A do que no grupo B (0,74±0,853 vs. 1,92±1,288, respectivamente, p=0,000). A mudança no escore da EVA após o tratamento em comparação com a linha basal também foi significativamente maior no grupo A do que no grupo B (6,24±2,01 vs. 4,34±2,32, respectivamente, p=0,000).
Os valores basais de DHI também foram semelhantes entre os grupos A e B (55,60±22,732 vs. 45,59±17,049, respectivamente, p=0,028). Após o tratamento, os valores de DHI foram significativamente menores em ambos os grupos. O grupo A apresentou melhores escores na EVA do que o grupo B (3,16±4,002 vs. 9,88±8,616, respectivamente, p=0,000). A mudança no escore do DHI após o tratamento em comparação com a linha basal foi significativamente maior no grupo A do que no grupo B (52,44±21,42 vs. 35,71±13,51, respectivamente, p=0,000) (tabela 1).
Parâmetros demográficos, escala visual analógica e dizziness handicap inventory em indivíduos que receberam terapia complementar com betaistina junto com manobra de reposicionamento canalítico para tratamento de vertigem posicional paroxística benigna posterior
| Total | Grupo A(n=50) | Grupo B(n=50) | p | |
|---|---|---|---|---|
| Idade | ||||
| Média±DP | 53,34±15,33 (alcance 18−65) | 55,68±14,534(alcance 29−82) | 50,96±15,911(alcance 16−85) | 0,126a |
| Sexo | ||||
| Masculino | 42 | 23 | 19 | 0,349b |
| Feminino | 58 | 27 | 31 | |
| Crise de vertigem anterior | ||||
| Presente | 47 (47%) | 21 (21%) | 26 (26%) | 0,270b |
| Ausente | 53 (53%) | 29 (29%) | 24 (24%) | |
| EVA | ||||
| Basal | 6,63±2,160 | 6,98±2,133 | 6,27±2,148 | 0,100a |
| Pós‐manobra de Epley | 1,32±1,236 | 0,74±,853 | 1,92±1,288 | 0,000a |
| Diferença | Diferença | Diferença | ||
| 5,30±2,36 | 6,24±2,01 | 4,34±2,32 | 0,000c | |
| p | 0,000 | 0,000 | ||
| DHI | ||||
| Basal | 50,65±20,640 | 55,60±22,732 | 45,59±17,049 | 0,028d |
| Pós‐manobra de Epley | 6,48±7,467 | 3,16±4,002 | 9,88±8,616 | 0,000d |
| Diferença | Diferença | Diferença | ||
| 44,16±19,73 | 52,44±21,42 | 35,71±13,51 | 0,000c | |
| p | 0,000 | 0,000 | ||
| Sucesso da manobra de Epley | ||||
| n=95 (95%) | n=48 (96%) | n=47 (94%) | 0,024b | |
Grupo A, manobra de Epley+terapia adjuvante com betaistina; Grupo B, manobra de Epley sozinha.
EVA, Escala visual analógica; DHI, Dizziness handicap inventory.
Este estudo randomizado controlado mostrou que o tratamento complementar com betaistina resultou em maior melhoria dos sintomas de VPPB, conforme verificado pelos escores na EVA e DHI. O mesmo não afetou a taxa de sucesso geral da manobra de reposicionamento canalicular (95%).
Uma revisão recente da Cochrane destacou a necessidade de pesquisas futuras rigorosas com relação ao tratamento da VPPB, inclusive o uso de critérios de inclusão rígidos para seleção de indivíduos, ferramentas‐padrão para diagnóstico, análises de poder do estudo e relatos de acordo com a declaração Consort.2 Nosso estudo atendeu à maioria desses requisitos.
A betaistina serve como uma opção de tratamento coadjuvante para vários distúrbios relacionados à tontura e vertigem e está em uso clínico desde 1968. O nível de evidência para betaistina é baixo para o tratamento geral da vertigem. No entanto, dados na literatura apoiam seu uso em vários tipos de vertigem com um bom perfil de segurança.8,11 Estudos recentes em todo o mundo indicaram que dois terços dos indivíduos com diagnóstico de vertigem recebem prescrição de betaistina, independentemente da etiologia.2 O estudo multicêntrico Virtuoso, que incluiu 305 indivíduos com vertigem, mostrou que a resposta clínica a 48mg de betaistina diária foi relatada como boa/excelente por 95,4% dos pacientes e 94,4% dos médicos que tratam a doença em ambientes de rotina.8 Os efeitos benéficos da betaistina nas crises mensais de vertigem foram evidentes durante o período de tratamento de 2 meses, mas o efeito não foi mais observado 2 meses após a interrupção do tratamento.
A betaistina age como um modulador da histamina, mas seu mecanismo de ação preciso não é conhecido. O principal efeito da betaistina é melhorar a microcirculação do orelha interna com vasodilatação. Na orelha interna o efeito antagônico da betaistina nos receptores H3 está relacionado ao aumento da liberação de neurotransmissores pelas terminações nervosas. Em combinação com os níveis elevados de histamina das terminações nervosas, o efeito agonista direto da betaistina nos receptores H1 expressos nos vasos sanguíneos da orelha interna facilita o fluxo sanguíneo.12
Na região coclear, a betaistina exerce seu efeito por meio de esfíncteres pré‐capilares localizados na estria vascular.9 O relaxamento dos esfíncteres pré‐capilares resulta em uma diminuição da pressão do saco endolinfático, o que pode explicar sua eficiência na doença de Ménière. A betaistina também pode afetar o disparo de neurônios nos núcleos vestibulares. Os efeitos da betaistina nos núcleos vestibulares laterais e mediais são dose‐dependentes.13
Embora a betaistina tenha um bom perfil de segurança,14 dados limitados estão disponíveis sobre seu uso em crianças e adolescentes e na população geriátrica.9 A dose típica é entre 8 e 48mg por dia. A betaistina é contraindicada Na presença de feocromocitoma, são necessários cuidados para seu uso em indivíduos com asma e úlcera péptica. Os efeitos colaterais frequentes incluem dor de cabeça e problemas gastrointestinais leves, mas seu perfil de segurança foi relatado como semelhante ao do placebo; uma revisão recente da Cochrane relatou que a betaistina e o placebo estão associados a eventos adversos em 16% e 15% dos indivíduos, respectivamente.2 Até o momento, duas reações adversas graves foram relatadas com o uso de betaistina em mais de 100 milhões de pessoas.14 Esses efeitos colaterais foram leves, dose‐dependentes e temporários. Em um estudo pós‐venda de rótulo aberto, Benecke et al. relataram uma incidência de eventos adversos associados à betaistina de 2,4% e a descontinuação do medicamento foi necessária em 17 (0,8%) indivíduos.11 Nenhum evento adverso foi relatado em nosso estudo e todos os indivíduos continuaram o tratamento.
As manobras de reposicionamento canalítico constituem o principal tratamento para a VPPB.7 As diretrizes de prática clínica apoiam o uso de manobras de reposicionamento canalicular no tratamento da VPPB.15 Vários estudos demonstraram sua eficácia. Prim‐Espada et al. publicaram uma metanálise sobre a eficácia da manobra de Epley no tratamento da VPPB.16 Os indivíduos tratados tiveram uma chance 6,5 vezes maior de melhoria dos sintomas (OR=6,52; IC95% 4,17–10,20) e uma chance 5 vezes maior de um teste de Dix‐Hallpike negativo (OR=5,19; IC95% 2,41–11,17) do que os controles. Nosso estudo teve uma taxa de sucesso geral de 95% para a manobra de reposicionamento canalicular.
Embora as manobras de reposicionamento canalítico sejam a base do tratamento, as opções para controle dos sintomas são limitadas. A betaistina foi avaliada para o controle dos sintomas em alguns estudos. Estudos anteriores indicaram sua eficácia em distúrbios vestibulares, particularmente na doença de Ménière. Stombolieva e Angov sugeriram que a betaistina melhora o fluxo sanguíneo no ouvido interno, o que pode ter um efeito positivo na instabilidade postural.4
Relatos anteriores sobre seu uso na VPPB indicaram que leva a uma recuperação mais rápida e melhor controle dos sintomas. Em uma metanálise de sete estudos, Della Pepa et al. relataram que a betaistina demonstrou efeitos benéficos em comparação com o placebo (OR=3,52, risco relativo de 1,78).17 Em um estudo com 90 indivíduos que consistiu em 30 tratados com a manobra de Epley+betaistina, 30 tratados apenas com a manobra de Epley e 30 tratados apenas com betaistina, Kaur e Shamanna relataram uma resposta melhor no grupo submetido à manobra de Epley+betaistina.3 Os indivíduos foram avaliados em uma e 4 semanas e aqueles que receberam a manobra de Epley mais betaistina experimentaram menos recorrência e recaída. No presente estudo, não incluímos um grupo de betaistina isolada, pois acreditamos que a principal modalidade de tratamento para VPPB é a manobra de Epley e que todos os indivíduos com VPPB deveriam receber esse tratamento inicialmente.
Cavaliere et al. compararam os efeitos da manobra de Semont e da manobra de Brandt‐Daroff com ou sem tratamento com betaistina em 103 indivíduos divididos em quatro grupos. Os indivíduos foram avaliados nos dias 3, 7, 14, 30, 60 e 90. Para as manobras liberatória e de Brandt‐Daroff, a terapia adjuvante com betaistina resultou em recuperação mais rápida em comparação com a respectiva manobra isolada.18 Esse efeito também foi evidente em pacientes mais velhos. Foi relatado que o uso de betaistina por mais de 3 meses não proporcionou benefício adicional e o uso de betaistina não afetou a taxa de melhoria final.
Güneri et al. conduziram um ensaio clínico duplo‐cego randomizado e controlado em uma população de 72 indivíduos com quatro escalas de sintomas de vertigem.5 O grupo de estudo consistiu em 24 indivíduos tratados apenas com a manobra de Epley, 24 que receberam a manobra de Epley+betaistina (24mg duas vezes ao dia) e 24 que receberam a manobra de Epley+placebo. A taxa de sucesso primária da manobra de Epley foi de 86,2%. Eles também descobriram que adicionar betaistina à manobra de Epley melhorou o controle dos sintomas. Esse efeito era evidente se os sintomas tivessem durado menos de um mês e se os indivíduos tivessem hipertensão, mas nenhum benefício adicional foi demonstrado para tontura residual. Mira et al. conduziram um estudo duplo‐cego, multicêntrico e controlado por placebo em 144 indivíduos (81 com doença de Ménière, 63 com VPPB). Demonstrou‐se que o uso da betaistina diminuiu a frequência, intensidade e duração dos crises de vertigem e melhorou os escores de qualidade de vida.19
A tontura residual apresentou taxas de 31% a 61% e podia durar várias semanas.1 Essa tontura pode ter um efeito adverso na qualidade de vida e aumentar a incidência de quedas em idosos. Jalali et al. conduziram um ensaio randomizado controlado por placebo em 117 indivíduos com VPPB posterior. Após a manobra de Epley, os indivíduos receberam uma semana de tratamento com betaistina, dimenidrinato ou placebo. Os autores fizeram análises de regressão logística e relataram que os indivíduos que receberam betaistina tiveram 3,18 vezes mais probabilidade de não apresentar tontura residual em comparação com o grupo placebo.1 Entretanto, os efeitos benéficos do tratamento com betaistina foram inversamente correlacionados com a idade.
Outros estudos não indicaram eficácia do tratamento adjuvante com betaistina. Acar et al. conduziram um estudo prospectivo em 100 indivíduos (25 receberam a manobra de Epley+betaistina, 25 receberam a manobra de Epley+trimetazidina, 25 receberam a manobra de Epley+Gingko Biloba e 25 foram submetidos à manobra de Epley apenas) com o questionário DHI e não encontraram diferenças significativas entre os grupos após 3 a 5 dias de tratamento.20
A principal limitação do presente estudo foi a falta de grupos que receberam somente betaistina e somente placebo. Como as manobras de reposicionamento canalítico são a base do tratamento da VPPB, não incluímos grupo não tratado ou grupo controle com placebo por razões éticas. Não fizemos avaliação adicional de longo prazo da tontura residual, pois a manobra de reposicionamento usada aqui tem excelentes taxas de controle de sintomas.
ConclusãoEmbora as manobras de reposicionamento canalítico continuem a ser a base do tratamento, a terapia complementar com betaistina resultou em melhor controle dos sintomas em indivíduos com VPPB posterior.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sayin I, Koç RH, Temirbekov D, Gunes S, Cirak M, Yazici ZM. Betahistine add‐on therapy for treatment of subjects with posterior benign paroxysmal positional vertigo: a randomized controlled trial. Braz J Otorhinolaryngol. 2022;88:421–6.
A revisão por pares é da responsabilidade da Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico‐Facial.